Нейрогенді қабыну, немесе NI - физиологиялық процесс, онда медиаторлар тері жасушаларының ішінен қабыну реакциясын бастау үшін тікелей шығарылады. Бұл жергілікті қабыну реакцияларын, соның ішінде эритеманы, ісінуді, температураны көтеруді, нәзіктікті және ауырсынуды тудырады. Төменгі қарқынды механикалық және химиялық ынталандыруларға жауап беретін мицелинфицирленген аферент-соматикалық С-талшықтары осы қабыну медиаторларын босату үшін негізінен жауапты.
Тітіркенген жүйкедегі бұл жүйке жолдары ынталандырғанда, энергетикалық нейропептидтерді немесе P және кальцитонин генімен байланысты пептитті (CGRP) жылдамдықпен микроағзаға шығарып, бірқатар қабыну реакцияларын тудырады. Иммуногенді қабынудың айтарлықтай айырмашылығы бар, ол иммундық жүйенің патогені денеге енген кезде ең алғашқы қорғаныс және қалпына келтіру әрекеті, ал неврогенді қабыну жүйке жүйесі мен қабыну реакциялары арасындағы тікелей байланысты білдіреді. Нейрогенді қабыну және иммунологиялық қабыну бір мезгілде болғанымен, екеуі клиникалық түрде бөлінбейді. Төмендегі мақалада нейрогенді қабыну механизмі мен перифериялық жүйке жүйесінің қорғаныс және иммунопатологиядағы рөлі талқыланады.
Мазмұны
Нейрогендік қабыну – Перифериялық жүйке жүйесінің хост қорғанысындағы және иммунопатологиядағы рөлі
дерексіз
Перифериялық жүйке және иммундық жүйе дәстүрлі түрде жеке функцияларды орындау ретінде қарастырылады. Алайда, бұл сызық нейрогендік қабынудың жаңа түсініктерімен көмескіленеді. Нокисепторлы нейрондар иммундық клеткалар сияқты қауіпке ұшыраған және қауіпке байланысты көптеген молекулалық тану жолдарына ие, перифериялық жүйке жүйесі иммундық жүйемен тікелей байланысады және интегралдық қорғау механизмін қалыптастырады. Шеткі маталардағы сенсорлы және автономды талшықтардың тығыз инвентаризация желісі және нейрондық трансфекцияның жоғары жылдамдығы иммунитеттің тез жергілікті және жүйелік нейрогендік модуляциясына мүмкіндік береді. Перифериялық нейрондар да аутоиммундық және аллергиялық ауруларда иммундық дисфункцияда маңызды рөл атқарады. Сондықтан перифериялық нейрондардың иммундық жасушалармен үйлесімді өзара әрекеттесуін түсіну, хост қорғауды күшейту және иммунопатологияны басу үшін терапевтік тәсілдерді жетілдіруі мүмкін.
кіріспе
Екі мың жыл бұрын Цельс қабынуды төрт негізгі белгілерден тұратын Долор (ауырсыну), Калор (ыстық), Рубор (қызару) және ісік (ісіну) деп анықтады, бұл бақылау жүйке жүйесінің белсендірілуінің ажырамас бөлігі ретінде танылғанын көрсетеді. қабыну. Дегенмен, ауырсыну негізінен сол уақыттан бері тек симптом ретінде қарастырылды, ал қабынудың генерациясының қатысушысы емес. Бұл перспективада біз перифериялық жүйке жүйесі туа біткен және адаптивті иммунитетті модуляциялауда тікелей және белсенді рөл атқаратынын көрсетеміз, осылайша иммундық және жүйке жүйелері қожайынның қорғанысында және тіндердің зақымдалуына жауап беруде жалпы біріктірілген қорғаныс функциясына ие болуы мүмкін. аллергиялық және аутоиммундық ауруларда патологияға әкелуі мүмкін өзара әрекеттесу.
Ағзалардың тіршілігі тіндердің зақымдануы мен инфекциядан болатын ықтимал зияннан қорғану қабілетіне байланысты. Хосттың қорғанысы қауіпті (зиянды) ортамен (жүйкелік функция) байланысты жою үшін аулақ болу әрекетін және патогендерді белсенді бейтараптандыруды (иммундық функция) қамтиды. Дәстүрлі түрде иммундық жүйенің жұқпалы агенттермен күресудегі және тіндердің зақымдануын қалпына келтірудегі рөлі жүйке жүйесінен айтарлықтай ерекшеленеді деп саналды, ол қоршаған орта мен ішкі сигналдарды сезімдер мен рефлекстерді тудыру үшін электрлік белсенділікке айналдырады (Cурет 1). Біз бұл екі жүйенің шын мәнінде біртұтас қорғаныс механизмінің құрамдас бөліктері екенін ұсынамыз. Соматосенсорлық жүйке жүйесі қауіпті анықтау үшін өте жақсы орналастырылған. Біріншіден, терінің эпителий беттері, өкпе, зәр шығару және ас қорыту жолдары сияқты сыртқы ортаның әсеріне қатты әсер ететін барлық ұлпалар ноцицепторлармен, жоғары табалдырықты ауырсыну тудыратын сенсорлық талшықтармен тығыз нервтенеді. Екіншіден, зиянды сыртқы тітіркендіргіштердің трансдукциясы дерлік лезде болады, туа біткен иммундық жүйені мобилизациялаудан жылдамырақ, сондықтан қожайынның қорғанысында «бірінші жауап беруші» болуы мүмкін.
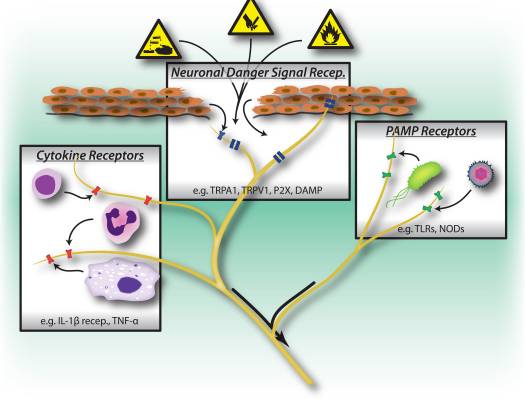
Сурет 1: Зиянды тітіркендіргіштер, микробтық және қабынуды тану жолдары перифериялық жүйке жүйесінің белсендірілуін тудырады. Сенсорлық нейрондарда зиянды/зиянды тітіркендіргіштердің болуын анықтаудың бірнеше құралдары бар. 1) Қауіпті сигнал рецепторлары, соның ішінде TRP арналары, P2X арналары және қауіпті байланысты молекулалық үлгі (DAMP) рецепторлары қоршаған ортадан экзогендік сигналдарды (мысалы, жылу, қышқылдық, химиялық заттар) немесе жарақат/тін жарақаты кезінде шығарылатын эндогендік қауіпті сигналдарды (мысалы, ATP, несеп қышқылы, гидроксиноненалдар). 2) Тол тәрізді рецепторлар (TLR) және түйін тәрізді рецепторлар (NLRs) сияқты үлгіні тану рецепторлары (PRRs) инфекция кезінде бактериялар немесе вирустар енген патогенмен байланысты молекулалық үлгілерді (PAMP) таниды. 3) Цитокиндік рецепторлар иммундық жасушалар (мысалы, IL-1beta, TNF-alpha, NGF) бөлетін факторларды таниды, олар карта киназаларын және мембрананың қозғыштығын арттыру үшін басқа да сигналдық механизмдерді белсендіреді.
Перифериядан жұлын мен миға ортодромдық кірістерден басқа, ноцицепторлық нейрондардағы әрекет потенциалдары периферияға, аксон рефлексіне кері тармақталған нүктелерде антидромикалық жолмен берілуі мүмкін. Олар тұрақты жергілікті деполяризациялармен бірге перифериялық аксондардан да, терминалдардан да нейрондық медиаторлардың тез және жергілікті шығарылуына әкеледі (2-сурет) 1. Гольцтың (1874 ж.) және Бейлисстің (1901 ж.) классикалық тәжірибелері арқа тамырларының электрлік ынталандыратынын көрсетті. терінің қан тамырларының кеңеюін тудырады, бұл иммундық жүйеден тәуелсіз «нейрогендік қабыну» тұжырымдамасына әкелді (Cурет 3).
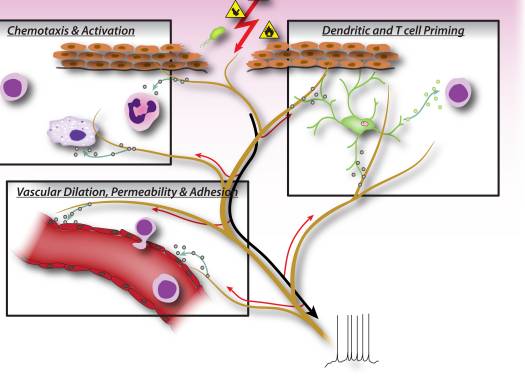
Сурет 2: Нокисепторлы сенсорлы нейроннан шыққан нейрондық факторлар лейкоциттердің химотаксисін, тамырлы гемодинамикасын және иммундық жауапты тікелей басқарады. Зиянды ынталандырғыш сенсорлық жүйкедегі афферентті сигналдарды белсендіргенде, нейрондық перифериялық терминалдарда нейропептидтердің шығарылуын тудыратын антидромикалық аксон рефлекстері пайда болады. Бұл молекулярлық медиаторларда бірнеше қабыну іс-әрекеттері бар: 1). Кемотаксис және нейтрофилдердің, макрофагтардың және лимфоциттердің зақымдану алаңына белсенуі және мастикалық жасушалардың деграданиясы. 2) қан айналымын, тамырлы ағуды және ісінуді арттыру үшін тамырлы эндотелия жасушаларына сигнал беру. Бұл сонымен қатар қабыну лейкоциттерін оңай жинауға мүмкіндік береді. 3) Th2 немесе Th17 субтитрлеріне келесі Т-көмекші жасушаларын саралауды жүргізу үшін дендрицалық жасушаларды дайындау.

Сурет 3: Celsus-ден қазіргі күнге дейін қабынудың нейрогендік аспектілерін түсінудегі жетістіктердің уақыт сызығы.
Нейрогенді қабыну 2-5 тамырлы эндотелий және тегіс бұлшықет жасушаларына тікелей әсер ететін ноцицепторлардан кальцитонин генімен байланысты пептид (CGRP) және P (SP) заты нейропептидтердің бөлінуімен жүзеге асады. CGRP 2, 3 қан тамырларының кеңею әсерін тудырады, ал SP плазманың экстравазациясына және ісінуге 4, 5 әкелетін капиллярлардың өткізгіштігін жоғарылатады, бұл Цельсустың руборын, калориясын және ісіктерін арттырады. Дегенмен, ноцицепторлар көптеген қосымша нейропептидтерді шығарады (онлайн деректер базасы: www.neuropeptides.nl/), соның ішінде адреномедуллин, А және В нейрокининдері, вазоактивті ішек пептидтері (VIP), нейропептид (NPY) және гастринді босататын пептид (GRP), сондай-ақ глутамат, азот оксиді (NO) және эотаксин сияқты басқа молекулалық медиаторлар 6.
Шеткі аймақтардағы сенсорлық нейрондардан бөлінетін медиаторлар қан тамырларына әсер етіп қана қоймай, сонымен бірге туа біткен иммундық жасушаларды (мастикалық жасушалар, дендритті жасушалар) және адаптивті иммундық жасушаларды (Т-лимфоциттер) 7�12 тікелей тартып, белсендіретінін түсінеміз. Тіндердің зақымдануының өткір жағдайында біз нейрогендік қабыну иммундық жасушаларды белсендіру және тарту арқылы физиологиялық жараларды емдеуді және патогендерге қарсы иммундық қорғанысты жеңілдететін қорғаныс болып табылады деп болжаймыз. Дегенмен, мұндай нейроиммундық байланыстар патологиялық немесе бейімделмейтін иммундық жауаптарды күшейту арқылы аллергиялық және аутоиммундық аурулардың патофизиологиясында маңызды рөл атқарады. Ревматоидты артриттің жануарлар үлгілерінде, мысалы, Левин мен оның әріптестері буынның денервациясы қабынудың айқын әлсіреуіне әкелетінін көрсетті, бұл P 13, 14 затының нейрондық экспрессиясына байланысты. Соңғы зерттеулерде тыныс жолдарының аллергиялық қабынуы, колит және псориаз, бастапқы сенсорлық нейрондар туа біткен және адаптивті иммунитетті белсендіруде және күшейтуде орталық рөл атқарады 15�17.
Сондықтан перифериялық жүйке жүйесі қорғаныс кезінде пассивті рөл атқармайды (зиянды ынталандыруды анықтау және қасақана мінез-құлық әрекетін бастау), сондай-ақ зиянды әсерге қарсы әрекет ету және күресу үшін иммундық жүйемен бірге белсенді рөл атқарады ынталандыру, ауруға ықпал ету үшін бұрмалануы мүмкін рөл.
Перифериялық жүйке және иммундық жүйедегі ортақ қауіпті тану жолдары
Перифериялық сенсорлық нейрондар организмге қарқынды механикалық, термиялық және тітіркендіргіш химиялық ынталандыруларға сезімталдығымен түсіну үшін бейімделген (сурет 1). Өтпелі рецепторлық потенциал (TRP) иондық каналдары нозицепцияның молекулярлық орталықтарының ең көп зерттелгендігімен, әртүрлі зиянды ынталандырулар арқылы белсендіру кезінде катиондарды селективті емес енгізуді жүргізеді. TRPV1 жоғары температура, төмен рН және капсаицинмен белсендірілген, Chili бұрыштарының 18 валиноид тітіркендіргіш компоненті. TRPA1 реактивтік химиялық заттарды анықтауға, соның ішінде, көздің жасанды газы мен индутиоцианаттар 19 сияқты қоршаған ортаға зиян келтіретін химиялық заттарды анықтайды, бірақ ең бастысы, 4-гидроксиноненал және 20, 21 простагландинді қоса алғанда эндогендік молекулярлық сигналдармен тіндік жарақат кезінде белсендіріледі.
Бір қызығы, сенсорлық нейрондық патогенді анықтауға мүмкіндік беретін тұқымдық иммундық жасушалар сияқты көптеген патогенді және қауіпті молекулалық тану рецепторларының жолдарын бөледі (Cурет 1). Иммундық жүйеде микробтық патогендер кеңейтілген сақталатын экзогендік патогенді байланысты молекулярлық үлгіні (PAMP) танитын гемаминдік кодталған пішінді тану рецепторлары (PRR) арқылы анықталады. Анықталатын алғашқы PRR-лар ашытқы, бактериядан алынған жасуша-қабырға компоненттері мен вирустық РНК 22-ға байланыстыратын толқын тәріздес рецепторлардың (TLR) отбасының мүшелері болды. PRR белсендіруден кейін, төменгі ағым сигналды жолдары қосылады, бұл цитокинді өндіруді және адаптивті иммунитетті белсендіруді тудырады. TLR-лерден басқа, тіндік зақымдану кезінде эндемді туындаған қауіпті сигналдармен тіндік иммундық жасушалар белсендіріледі, сонымен қатар зақымданумен байланысты молекулярлық үлгілер (DAMP) немесе 23, 24 дабылдары деп аталады. Бұл қауіпті сигналдарға HMGB1, мочевая қышқылы және некроз кезінде өлетін жасушалар шығаратын жылу соққы белоктар кіреді, инфекциялық емес қабыну реакциялар кезінде иммундық жасушаларды белсендіреді.
PRR, соның ішінде TLR 3, 4, 7 және 9 ноцицепторлық нейрондар арқылы экспрессияланады, ал TLR лигандтары арқылы ынталандыру ішкі ағымдардың индукциясына және ноцицепторлардың басқа ауырсыну тітіркендіргіштеріне сенсибилизациясына әкеледі 25�27. Сонымен қатар, сенсорлық нейрондардың TLR7 лиганд имиквимодпен белсендірілуі қышымаға тән сенсорлық жолдың белсендірілуіне әкеледі 25. Бұл нәтижелер инфекциямен байланысты ауырсыну мен қышыну ішінара патогендік факторлардың нейрондардың тікелей белсендірілуіне байланысты болуы мүмкін екенін көрсетеді, бұл өз кезегінде нейрондық сигналдық молекулалардың перифериялық босатылуы арқылы иммундық жасушаларды белсендіреді.
Жасуша зақымдануы кезінде бөлінетін негізгі DAMP/алармин АТФ болып табылады, оны ноцицепторлық нейрондардағы және иммундық жасушалардағы пуринергиялық рецепторлар 28�30 таниды. Пуринергиялық рецепторлар екі отбасынан тұрады: P2X рецепторлары, лигандты катион арналары және P2Y рецепторлары, G-белокпен байланысқан рецепторлар. Ноцицепторлы нейрондарда АТФ тану P2X3 арқылы жүреді, бұл катиондық токтардың тез тығыздалуына және ауырсынуға әкеледі 28, 30 (1-сурет), ал P2Y рецепторлары TRP және кернеумен жабылған натрий арналарының сенсибилизациясы арқылы ноцицепторлардың белсендірілуіне ықпал етеді. Макрофагтарда P2X7 рецепторларымен АТФ байланысуы гиперполяризацияға және IL-1beta және IL-18 29 генерациясында маңызды молекулалық кешен болып табылатын қабынудың төменгі ағымында белсендірілуіне әкеледі. Сондықтан ATP перифериялық нейрондарды да, туа біткен нейрондарды да белсендіретін күшті қауіпті сигнал болып табылады. жарақат кезінде иммунитет және кейбір дәлелдер тіпті нейрондардың қабыну молекулалық аппаратының бөліктерін білдіретінін көрсетеді 31.
Нокисепторлардағы қауіпті сигналдардың жағы - иммундық жасушаларды белсендіруде TRP арналарының рөлі. TRPV2, зиянды жылумен белсендірілген TRPV1 гомологы, 32 туа біткен иммундық жасушаларында жоғары деңгейде көрінеді. TRPV2 генетикалық абляциясында макрофаг фагоцитозы мен бактериялы инфекциялардың 32 тазалығы бұзылған. Сонымен қатар, Mast жасушалары TRPV арналарын білдіреді, олар өздерінің деграданиясын 33-ке тікелей жібере алады. Эндогендік қауіп-қатер сигналдары иммундық жасушаларды нозицепторлар сияқты белсендіре алатынын анықтайды.
Иммундық жасушалар мен ноцицепторлық нейрондар арасындағы байланыстың негізгі құралы цитокиндер арқылы болып табылады. Цитокиндік рецепторлар белсендірілгеннен кейін сенсорлық нейрондарда сигнал беру жолдары белсендіріледі, бұл мембраналық ақуыздардың төменгі ағынды фосфорлануына әкеліп соғады, соның ішінде TRP және кернеуі бар арналар (1-сурет). Нәтижесінде ноцицепторлардың сенсибилизациясы әдетте зиянсыз механикалық және жылулық тітіркендіргіштердің енді ноцицепторларды белсендіре алатынын білдіреді. Интерлейкин 1 бета және TNF-альфа - қабыну кезінде туа біткен иммундық жасушалар шығаратын екі маңызды цитокин. IL-1beta және TNF-alpha туыстық рецепторларды білдіретін ноцицепторлармен тікелей сезіледі, p38 карта киназаларының активтенуін индукциялайды, бұл мембрананың қозғыштығын 34�36 жоғарылатады. Жүйке өсу факторы (NGF) және простагландин E(2) да сенсибилизацияны тудыратын перифериялық сенсорлық нейрондарға тікелей әсер ететін иммундық жасушалардан бөлінетін негізгі қабыну медиаторлары болып табылады. Иммундық факторлар арқылы ноцицепторларды сенсибилизациялаудың маңызды әсері иммундық жасушаларды одан әрі белсендіретін, осылайша қабынуды қоздыратын және жеңілдететін оң кері байланыс тізбегін индукциялайтын перифериялық терминалдарда нейропептидтердің жоғарылауы болып табылады.
Интенсивті және адаптивті иммунитетті сезімтал жүйке жүйесі
Қабынудың ерте кезеңдерінде сенсорлық нейрондар иммундық жауапты бастауда маңызды туа біткен иммундық жасушалар болып табылатын тіндердің резиденттік жасушалары мен дендритті жасушаларға сигнал береді (2-сурет). Анатомиялық зерттеулер терминалдардың мастикалық жасушалармен, сондай-ақ дендритті жасушалармен тікелей орналасуын көрсетті және ноцицепторлардан бөлінген нейропептидтер осы жасушаларда дегрануляцияны немесе цитокиндерді өндіруді тудыруы мүмкін 7, 9, 37. Бұл өзара әрекеттесу аллергиялық тыныс жолдарында маңызды рөл атқарады. қабыну және дерматит 10�12.
Қабынудың эффекторлық фазасында иммундық жасушалар белгілі бір жарақат орнына жол табуы керек. Сенсорлық нейрондардан, нейропептидтерден, хемокиндерден және глутаматтан бөлінетін көптеген медиаторлар нейтрофилдер, эозинофилдер, макрофагтар және Т-клеткалары үшін хемотактикалық болып табылады және иммундық жасушалардың орналасуын жеңілдететін эндотелий адгезиясын күшейтеді 6, 38�41 (Cурет 2). Сонымен қатар, кейбір дәлелдер нейрондардың эффекторлық фазаға тікелей қатысуы мүмкін екенін білдіреді, өйткені нейропептидтердің өздері тікелей микробқа қарсы функцияларға ие болуы мүмкін 42.
Нейрондық жолмен алынған сигналдық молекулалар, сондай-ақ бейімделу иммундық Т-клеткаларының әртүрлі түрлерін дифференциациялауға немесе спецификациялауға ықпал ете отырып, қабыну түрін бағыттай алады. Антиген туа біткен иммундық жасушалармен фагоцитозданады және өңделеді, олар жақын маңдағы лимфа түйініне көшіп, антигендік пептидті қарапайым Т жасушаларына береді. Антиген түріне, туа біткен иммундық жасушадағы костимуляциялық молекулаларға және спецификалық цитокиндердің комбинацияларына байланысты, аңқау Т-клеткалары патогендік қоздырғышты тазарту үшін қабыну әрекетіне жақсы қызмет ететін арнайы субтиптерге жетіледі. CD4 Т жасушалары немесе Т көмекші (Th) жасушаларын төрт негізгі топқа бөлуге болады: Th1, Th2, Th17 және Т реттеуші жасушалар (Treg). Th1 жасушалары негізінен жасушаішілік микроорганизмдерге және органға тән аутоиммунды ауруларға иммундық жауаптарды реттеуге қатысады; Th2 гельминттер сияқты жасушадан тыс патогендерге қарсы иммунитет үшін өте маңызды және аллергиялық қабыну ауруларына жауап береді; Th17 жасушалары жасушадан тыс бактериялар мен саңырауқұлақтар сияқты микробтық қиындықтардан қорғауда орталық рөл атқарады; Трег жасушалары өзін-өзі толеранттылықты сақтауға және иммундық жауаптарды реттеуге қатысады. Бұл Т-жасушаның жетілу процесіне сенсорлық нейрондық медиаторлар қатты әсер еткен сияқты. CGRP және VIP сияқты нейропептидтер дендритті жасушаларды Th2 типті иммунитетке бейімдеп, кейбір цитокиндердің өндірісін ынталандыру және басқаларын тежеу, сондай-ақ дендритті жасушалардың жергілікті лимфа түйіндеріне көшуін азайту немесе күшейту арқылы Th1 типті иммунитетті төмендетуі мүмкін. , 8, 10. Сенсорлық нейрондар сонымен қатар аллергиялық (негізінен Th43 әсерінен болатын) қабынуға айтарлықтай үлес қосады. 2, 17, бұл нейрондардың қабынуды реттеуге қатысуы мүмкін екенін білдіреді. Колит және псориаз сияқты иммунопатологияларда P субстанциясы сияқты нейрондық медиаторлардың блокадасы Т-жасушасын және иммундық делдалдық зақымдануды 1-2 айтарлықтай төмендетуі мүмкін, дегенмен бір медиаторды антагонизациялау өздігінен нейрогендік қабынуға шектеулі әсер етуі мүмкін.
Перифериялық сенсорлық жүйке талшықтарынан босатылған сигнал беретін молекулалардың кіші қан тамырларын ғана емес, сонымен қатар иммусты клеткалардың химотаксисін, үйленуін, жетілуін және белсендіруін реттейтінін ескере отырып, нейро-иммундық өзара әрекеттесу бұрын ойлағаннан әлдеқайда күрделі 2). Сонымен қатар, бұл жеке нейрондық медиаторлар емес, әр түрлі этаптар мен иммундық жауап түрлеріне әсер ететін нозицепторлардан босатылған сигнал молекулаларының арнайы комбинациясы.
Иммунитеттің автономдық рефлексі
Перифериялық иммундық жауаптарды реттеудегі холинергиялық вегетативті жүйке жүйесінің «рефлекс» тізбегінің рөлі де маңызды болып табылады. Кевин Трейси және басқалардың жұмысы перифериялық макрофагтардың басылуына әкелетін септикалық шок пен эндотоксемия кезіндегі күшті жалпыланған қабынуға қарсы жауаптарды көрсетеді, бұл перифериялық макрофагтардың басылуына әкелетін эфферентті вагальды жүйке белсенділігі арқылы іске қосылады. Вагус көкбауырды иннервациялайтын перифериялық адренергиялық целиак ганглиондарының нейрондарын белсендіреді, бұл көкбауыр мен асқазан-ішек жолындағы макрофагтардағы альфа-46 никотиндік рецепторлармен байланысатын ацетилхолиннің төменгі ағынына әкеледі. Бұл TNF-альфа транскрипциясын 47 күшті басатын JAK49/STAT7 SOCS2 сигналдық жолының активтенуін индукциялайды. Адренергиялық целиак ганглиясы сонымен қатар қабыну макрофагтарын басатын ацетилхолинді шығаратын жады Т жасушаларының ішкі жиынымен тікелей байланысады3.
Инвариантты табиғи Killer T-клеткалары (iNKT) пептидті антигендердің орнына CD1d контекстінде микробтық липидті танитын T-клеткаларының мамандандырылған жиынтығы болып табылады. NKT жасушалары инфекциялық патогенділермен күресуге және жүйелік иммунитетті реттеуге қатысатын негізгі лимфоциттер популяциясы болып табылады. NKT жасушалары негізінен көкбауыр мен бауырдың қан тамырлары мен синусоидылары арқылы тұрады және тасымалдайды. Бауырдағы симпатикалық бета-адренерген нервтері NKT жасушалық белсенділігін модульдеу үшін сигнал береді. Инсульт тінтіуірінің моделі кезінде, мысалы, бауыр NKT жасушалық қозғалғыштығы симпатикалық денервация немесе бета-адренергиялық антагонисты арқылы қалпына келтірілді. Сонымен қатар, NKT жасушаларында норадренергиялық нейрондардың бұл иммуносупрессивтік белсенділігі жүйелі инфекцияның және өкпе зақымдалуының өсуіне әкелді. Осылайша, автономды нейрондық эффентті сигналдар күшті иммундық қысымға әкелуі мүмкін.

Доктор Алекс Хименездің түсінігі
Нейрогенді қабыну - бұл жүйке жүйесімен туындаған локальды қабыну реакциясы. Мигрин, псориаз, астма, фибромиалгия, экзема, розацеа, дистония және көптеген химиялық сезімталдықты қамтитын көптеген денсаулық мәселелерінің патогенезінде іргелі рөл ойнайды деп саналады. Перифериялық жүйке жүйесімен байланысты нейрогендік қабыну терең зерттелсе де, орталық жүйке жүйесіндегі нейрогенді қабыну тұжырымдамасы бұрынғы зерттеулерді қажет етеді. Бірнеше зерттеулерге сәйкес, магний жетіспеушілігі нейрогенді қабынудың негізгі себебі деп саналады. Келесі мақалада жүйке жүйесіндегі нейрогенді қабыну механизмдерінің шолуы көрсетілген, бұл жүйке жүйесімен байланысты көптеген денсаулық сақтау мәселелерін шешу үшін медицина қызметкерлеріне үздік емдеу әдісін анықтауға көмектеседі.
Қорытындылар
Қабыну мен иммундық жүйені реттеудегі соматосенсорлық және вегетативті жүйке жүйесінің сәйкес спецификалық рөлдері қандай (4-сурет)? Ноцицепторлардың белсендірілуі жергілікті аксондық рефлекстерге әкеледі, олар жергілікті түрде иммундық жасушаларды тартады және белсендіреді, демек, негізінен қабынуға қарсы және кеңістікте шектелген. Керісінше, вегетативті ынталандыру бауыр мен көкбауырдағы иммундық жасушалар пулдарына әсер ету арқылы жүйелі иммуносупрессияға әкеледі. Иммуносупрессивті вагальді холинергиялық рефлекторлық контурды қоздыруға әкелетін перифериядағы афферентті сигналдық механизмдер нашар зерттелген. Дегенмен, вагальды талшықтардың 80-90% бастапқы афферентті сенсорлық талшықтар болып табылады, сондықтан көпшілігі иммундық жасушалармен басқарылатын ішкі органдардан келетін сигналдар ми бағанасында интернейрондардың белсендірілуіне және олар арқылы эфферентті вагалық талшықтардың шығуына әкелуі мүмкін 46.
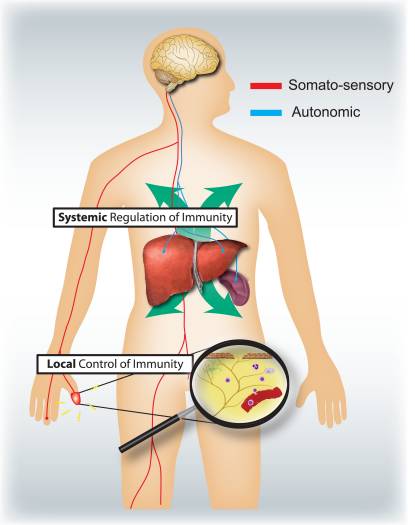
Сурет 4: Сенсорлы және автономды жүйке жүйелері жергілікті және жүйелік иммундық жауаптарды модуляциялайды. Эпителиалдық беттердің (мысалы, тері және өкпе) нозицательттері локализацияланған қабыну реакцияларын тудырады, маст және жасуша жасушаларын белсендіреді. Аллергиялық тыныс жолдарының қабынуы, дерматит және ревматоидты артрит кезінде, нозицепторлық нейрон қабынуды қоздыруда маңызды рөл атқарады. Керісінше, висцеральды мүшелерді (мысалы, селезенк және бауыр) инверсиялық тізбектер макрофагты және NKT жасушаларын белсендіруді шектеп, жүйелік иммундық жауаптарды реттейді. Инсульт пен септикалық эндотоксемия кезінде бұл нейрон иммуносупрессивтік рөл атқарады.
Әдетте, инфекция кезінде, аллергиялық реакцияларда немесе авто-иммундық патологияда болған қабынудың уақыты мен сипаты иммундық жасушалардың категорияларымен анықталады. Иммундық жасушалардың әртүрлі типтерінің сенсорлық және автономдық сигналдармен реттелетінін білу маңызды. Бұл мәселені шешуге неосикепорлар мен автономды нейрондардан босатылуы мүмкін медиаторларды жүйелі бағалау және әртүрлі туа біткен және адаптивті иммундық жасушалар үшін рецепторлардың білдіруі мүмкін.
Эволюция барысында қауіпті анықтаудың ұқсас молекулярлық жолдары туа біткен иммунитет үшін де, ноцицепция үшін де дамыды, дегенмен жасушалардың даму линиялары мүлдем басқаша. PRR және зиянды лигандпен жабылған иондық арналарды иммунологтар мен нейробиологтар бөлек зерттесе де, бұл екі өріс арасындағы сызық барған сайын бұлыңғыр болады. Тіндердің зақымдануы және патогендік инфекция кезінде қауіпті сигналдардың шығарылуы күрделі екі жақты байланысы бар перифериялық нейрондар мен иммундық жасушалардың үйлестірілген белсендірілуіне және біріктірілген хост қорғанысына әкелуі мүмкін. Ноцицепторлардың қоршаған ортамен интерфейстегі анатомиялық орналасуы, жүйкелік трансдукция жылдамдығы және олардың иммундық әсер ететін медиаторлардың күшті коктейльдерін шығару қабілеті перифериялық жүйке жүйесіне туа біткен иммундық жауапты белсенді түрде модуляциялауға және төменгі ағындағы адаптивті иммунитетті үйлестіруге мүмкіндік береді. Керісінше, ноцицепторлар нейрондарды белсендіретін және сезімтал ететін иммундық медиаторларға өте сезімтал. Нейрогенді және иммундық-делдалдық қабыну, демек, тәуелсіз субъектілер емес, олар ертерек ескерту құралдары ретінде бірге әрекет етеді. Дегенмен, перифериялық жүйке жүйесі астма, псориаз немесе колит сияқты көптеген иммундық аурулардың патофизиологиясында және этиологиясында маңызды рөл атқарады, өйткені оның иммундық жүйені белсендіру қабілеті патологиялық қабынуды күшейтуі мүмкін 15�17. Иммундық бұзылыстарды емдеу иммундық жасушалармен қатар ноцицепторларды да қамтуы қажет болуы мүмкін.
Алғыс
Біз NIH қолдауына (2R37NS039518) алғысымызды білдіреміз.
Қорытындысында,Нейрогендік қабынудың рөлін түсіну жүйке жүйесінің денсаулығының әртүрлі мәселелерін емдеудің дұрыс әдісін анықтау үшін маңызды. Перифериялық нейрондардың иммундық жасушалармен өзара әрекеттесуіне қарай отырып, денсаулық сақтау мамандары хосттың қорғанысын арттыруға, сондай-ақ иммунопатологияны басуға көмектесетін терапевтік әдістерді алға жылжыта алады. Жоғарыдағы мақаланың мақсаты пациенттерге жүйке жарақатының денсаулық мәселелерімен қатар нейропатияның клиникалық нейрофизиологиясын түсінуге көмектесу болып табылады. Ақпарат Ұлттық биотехнологиялық ақпарат орталығынан (NCBI) алынған. Біздің ақпаратымыздың көлемі хиропротикамен, сондай-ақ омыртқаның жарақаттары мен жағдайларымен шектеледі. Тақырыпты талқылау үшін доктор Хименеске хабарласыңыз немесе бізге телефон арқылы хабарласыңыз915-850-0900 .
Доктор Алекс Хименес мырзаның жетекшілігімен
Қосымша тақырыптар: Back Pain
Арқа ауруы мүгедектіктің ең көп таралған себептерінің бірі және бүкіл әлем бойынша жұмыстан босатылған күндер. Іс жүзінде ауырсыну дәрігерге барудың екінші ең көп тараған себебі ретінде анықталды, бұл тек жоғарғы тыныс жолдарының жұқпалы ауруларымен ғана шектеледі. Шамамен 80 пайызы өмір сүру кезеңінде кем дегенде бір рет арқа ауруы кез-келген түрін сезінеді. Омыртқасы - бұл жұмсақ маталардан тұратын сүйек, буын, байлам және бұлшықеттерден тұратын күрделі құрылым. Осыған байланысты жарақаттар және / немесе ауырлататын жағдайлар сияқты қатты дискілер, ақыр соңында арқа ауырсыну белгілеріне алып келуі мүмкін. Спорттық жарақаттар немесе автомобиль апатының жарақаттары көбінесе арқадағы ауырсынудың жиі себебі болып табылады, бірақ кейде ең қарапайым қозғалыстың ауыр нәтижесі болуы мүмкін. Бақытымызға орай, широпрактикалық күтім сияқты альтернативті емдеу параметрлері омыртқаның түзетуін және манипуляцияларды қолдану арқылы ауырсынуды жеңілдетуге көмектеседі, ақыр соңында ауруды жеңілдетеді.

ҚОСЫМША МАҢЫЗДЫ ТАҚЫРЫП: Төмен Back Pain Management
ТАҒЫ ТАҚЫРЫПТАР: ҚОСЫМША ҚОСЫМША: Созылмалы ауру және емдеу
Бос
Әдебиеттер тізімі
Аккордеонды жабыңыз
Мұндағы ақпарат «Нейрогенді қабынудың рөлі" білікті денсаулық сақтау маманымен немесе лицензиясы бар дәрігермен жеке қарым-қатынасты ауыстыруға арналмаған және медициналық кеңес емес. Біз сізді зерттеулеріңізге және білікті денсаулық сақтау маманымен серіктестікке негізделген денсаулық сақтау туралы шешім қабылдауға шақырамыз.
Блог туралы ақпарат және ауқымды талқылау
Біздің ақпараттық шеңберіміз хиропрактика, тірек-қимыл аппараты, физикалық дәрі-дәрмектер, сауықтыру, этиологиялық әсер етумен шектеледі. висцеросоматикалық бұзылулар клиникалық көрсетілімдер, соматовисцеральды рефлекстің клиникалық динамикасы, сублюксация кешендері, денсаулыққа қатысты сезімтал мәселелер және/немесе функционалдық медицина мақалалары, тақырыптары және талқылаулары.
Біз қамтамасыз етеміз және ұсынамыз клиникалық ынтымақтастық түрлі сала мамандарымен. Әрбір маман өзінің кәсіби тәжірибесімен және лицензиялау юрисдикциясымен реттеледі. Біз тірек-қимыл аппаратының жарақаттары мен бұзылыстарын емдеу және қолдау үшін денсаулық пен сауықтыру функционалдық протоколдарын қолданамыз.
Біздің бейнелеріміз, жазбаларымыз, тақырыптарымыз, тақырыптарымыз және түсініктемелеріміз клиникалық тәжірибемізге тікелей немесе жанама түрде қатысты және оған қатысты мәселелерді, мәселелерді және тақырыптарды қамтиды*.
Біздің кеңсе дәлелді дәйексөздер беруге тырысты және біздің жазбаларымызды қолдайтын тиісті зерттеулерді немесе зерттеулерді анықтады. Сұраным бойынша біз бақылау кеңестеріне және қоғамға қол жетімді ғылыми зерттеулердің көшірмелерін ұсынамыз.
Біз оның белгілі бір күтім жоспарында немесе емдеу хаттамасында қалай көмектесе алатындығы туралы қосымша түсініктеме талап ететін мәселелерді қарастыратынымызды түсінеміз; сондықтан, жоғарыда аталған тақырыпты одан әрі талқылау үшін, сұраңыз Доктор Алекс Хименес, Колумбия округі, Немесе бізбен хабарласыңыз 915-850-0900.
Біз сізге және сіздің отбасыңызға көмектесу үшін осындамыз.
баталар
Доктор Алекс Хименес Тұрақты, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
электрондық пошта: train@elpasofunctionalmedicine.com
Хиропрактика докторы (DC) ретінде лицензияланған Техас & New Mexico*
Texas DC лицензиясы № TX5807, Нью-Мексико DC лицензиясы № NM-DC2182
Тіркелген медбике (RN*) лицензиясы бар in Флорида
Флорида лицензиясы RN лицензиясы # RN9617241 (Басқару №. 3558029)
Шағын күйі: Көп штаттық лицензия: Тәжірибе жасауға рұқсат етілген 40 штаттары*
Доктор Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Менің цифрлық визит карточкам