1. ДДҰ. ДДҰ | Артық салмақ және семіздік. www.who.int/gho/ncd/
risk_factors/overweight/en/index.html. 29 жылдың 2015 қаңтарында қол жеткізілді.
2. Виссшер ПМ, Браун М.А., МакКарти М.И., Янг Дж. GWAS ашылуының бес жылдығы.
Мен Дж Хум Дженет. 2012;90:7�24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, т.б. Генетикалық
Дене салмағының индексін зерттеу семіздік биологиясы үшін жаңа түсініктер береді. Табиғат.
2015; 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, Rïnn T, Granhall C, Luthman H, т.б.
Адамның 1 типті диабеттік аралдарда PPARGC2A эпигенетикалық реттелуі және
инсулин секрециясына әсері. Қант диабеті. 2008;51:615�22.
5. Ван Дейк СДж, Моллой П.Л., Варинли Х, Моррисон Дж.Л., Мулхауслер Б.С. Эпигенетика
және адамның семіздігі. Int J Obes (Лондия). 2015;39:85�97.
6. Тех АЛ, Пан Х, Чен Л, Онг МЛ, Догра С, Вонг Дж, т.б. әсері
генотип және жаңа туған нәрестедегі индивид аралық вариация бойынша жатыр ортасы
ДНҚ метиломдары. Genome Res. 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA және т.б. Геном бойынша
генетикалық және эпигенетикалық вариация әсерінің арасындағы байланыстар
Адамның ұйқы безі аралдарында мРНҚ экспрессиясы және инсулин секрециясы. PLoS
Генет. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, т.б.
Егіздердің майлы тіндеріндегі ДНҚ метилденуінің вариациясының жаһандық талдауы
дистальды реттеуші элементтердегі аурумен байланысты нұсқаларға сілтемелерді ашады.
Мен Дж Хум Дженет. 2013;93:876�90.
9. Ронн Т, Волков П, Гиллберг Л, Кокосар М, Перфильев А, Якобсен А.Л., т.б.
Жастың, BMI және HbA1c деңгейлерінің геномдық ДНҚ-ға әсері
адамның май тініндегі метилдену және мРНҚ экспрессия үлгілері
және қандағы эпигенетикалық биомаркерлерді анықтау. Хум Мол Генет.
2015; 24: 3792 813.
10. Waterland RA, Michels KB. Дамудың эпигенетикалық эпидемиологиясы
шығу тегі гипотезасы. Анну Рев Нутр. 2007;27:363�88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, т.б. Кейінгі семіздіктің ерте пайда болуы: жолдары мен механизмдері. Adv
Exp Med Biol. 2009;646:71�81.
12. Равелли А, ван дер Меулен Дж, Мишельс Р, Осмонд С, Баркер Д, Хейлс С және т.б.
Ашаршылықтың пренатальды әсерінен кейінгі ересектердегі глюкозаға төзімділік. Лансет.
1998; 351: 173 7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Моррисон Дж.Л. Ересектер денсаулығы мен ауруларының даму бастаулары: рөлі
периконцепциялық және ұрықтың тамақтануы. Basic Clin Pharmacol Toxicol.
2008; 102: 82 9.
14. Чжан С, Раттанатрей Л, МакМиллен IC, Сутер СМ, Моррисон Дж.Л. Периконцепциялық
тамақтану және семіздік немесе қиыншылық өмірін ерте бағдарламалау. Прог
Биофиз Мол Биол. 2011;106:307�14.
15. Bouret S, Levin BE, Ozanne SE. Ген-ортаның өзара әрекеттесуін бақылау
энергия мен глюкоза гомеостазы және семіздіктің даму бастаулары.
Physiol Rev. 2015;95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, т.б.
Ананың семіздігі ақ май тінінің дифференциациясын жақсартады және өзгертеді
аталық егеуқұйрық ұрпақтарындағы геномдық масштабтағы ДНҚ метилденуі. Эндокринология.
2013; 154: 4113 25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
т.б. Сүтқоректілердің дамуындағы метаболикалық пластика бағытталған
ерте тамақтану жағдайына байланысты. Proc Natl Acad Sci АҚШ А.
2007; 104: 12796 800.
18. Годфри КМ, Шеппард А, Глакман ПД, Лилликроп КА, Бурдж ГК, Маклин С,
т.б. Эпигенетикалық геннің промоторы туған кездегі метилденумен байланысты
баланың кейінгі семіздігі. Қант диабеті. 2011;60:1528�34.
19. McMillen IC, Adam CL, Muhlhausler BS. Семіздіктің ерте пайда болуы:
тәбетті реттеу жүйесін бағдарламалау. J Physiol. 2005;565(Pt 1):9�17.
20. Бегум Г, Стивенс А, Смит ЭБ, Коннор К, Чаллис Дж.Р, Блумфилд Ф, т.б.
Ұрықтың гипоталамус энергиясын реттеу жолдарының эпигенетикалық өзгерістері болып табылады
ананың жеткіліксіз тамақтануымен және егіздікпен байланысты. ФАСЕБ Дж.
2012; 26: 1694 703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY және т.б. Ананың семіздігі
және қант диабеті сперматозоидтардағы ДНҚ метилденуінің өзгеруіне әкелуі мүмкін
тышқандардағы ұрпақ. Биол эндокринолды көбейтіңіз. 2014;12:29.
22. Джоус С, Парри Л, Ламберт-Ланглайс С, Маурин AC, Аверус Дж, Брухат А және т.б.
Перинаталдық жеткіліксіз тамақтану лептиннің метилденуіне және экспрессиясына әсер етеді
Ересектердегі ген: метаболикалық синдромды түсінуге әсер ету.
FASEB J. 2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
Жүктілік кезіндегі ананың диетасы гендердің экспрессиясын және ДНҚ-ны тудырады
қойлардың ұрық тіндеріндегі метилдену өзгерістері. Front Genet. 2013;4:49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, т.б.
Ананың семіздігі мен қант диабеті жасырын метаболикалық ақауларды тудырады және
изогенді тышқандардағы кең таралған эпигенетикалық өзгерістер. Эпигенетика. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Диеталық ақуыз
жүкті егеуқұйрықтарды шектеу индукциялайды және фолий қышқылын толықтыруды болдырмайды
ұрпақтардағы бауыр генінің экспрессиясының эпигенетикалық модификациясы. J Nutr.
2005; 135: 1382 6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, т.б. жатырда
әсерлері. Жатырдағы жеткіліксіз тамақтану ересек сперматозоидты метиломды бұзады
және ұрпақ аралық зат алмасу. Ғылым. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, т.б.
Эпигеномика: ананың жатырдағы жоғары майлы диетасы бұзылады
адам емес приматтардағы перифериялық циркадтық ген экспрессиясы. ФАСЕБ Дж.
2011; 25: 714 26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, т.б. жатырда
Ананың жоғары майлы диетасының әсері а-дағы эпигенетикалық гистондық кодты өзгертеді
тышқан үлгісі. Am J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, т.б.
Бағдарламаланған семіздіктің эпигенетикасы: IUGR егеуқұйрық IGF1 бауырындағы өзгеріс
mRNA экспрессиясы және гистон құрылымы тез және кейінге қалдырылған постнатальды
қуып жететін өсу. Am J Physiol Gastrointest Liver Physiol.
2010;299:G1023�9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
т.б. Ананың диетасы және қартаюы промоутерлендіргіштің эпигенетикалық бақылауын өзгертеді
егеуқұйрықтардың ұйқы безінің аралдарында Hnf4a генінің өзара әрекеттесуі. Proc Natl
Acad Sci US A. 2011;108:5449�54.
31. Брауншвейг М, Джаганнатхан В, Гутцвиллер А, Би Г.
F2 шошқаларындағы аталық сызығы бойынша трансгенерациялық эпигенетикалық жауап. PLoS
Бір. 2012;7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, т.б. Әкелік
метаболизмнің индукцияланған трансгенерационды қоршаған ортаны қайта бағдарламалауы
сүтқоректілердегі гендердің экспрессиясы. Ұяшық. 2010;143:1084�96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, т.б. Әкелік диета
ұрпақтың хроматин күйін және ұрпақ аралық семіздікті анықтайды. Ұяшық.
2014; 159: 1352 64.
34. Мартюнез Д, Пентинат Т, Рибь С, Дэвиуд С, Bloks VW, Себрий Дж, т.б. жатырда
еркек тышқандардағы жеткіліксіз тамақтану екінші ұрпақтағы бауырдың липидті метаболизмін бағдарламалайды
өзгертілген Lxra ДНҚ метилденуі қатысатын ұрпақ. Жасуша метаб.
2014; 19: 941 51.
35. Вэй Ю, Ян CR, Вэй Ю, Чжао З.А., Хоу Ю, Шаттен Н және т.б. Әкелік
қант диабетіне бейімділіктің трансгенерационды тұқым қуалауы
сүтқоректілер. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Гроссниклаус У, Келли В.Г., Келли Б, Фергюсон-Смит AC, Пембри М, Линдквист
S. Трансгенерациялық эпигенетикалық тұқым қуалаушылық: оның қаншалықты маңыздылығы бар? Нат Аян
Генет. 2013;14:228�35.
37. Пембри М, Саффери Р, Байгрен Л.О. Адамның трансгенеративтік реакциялары
ерте өмір тәжірибесі: дамуға, денсаулыққа және
биомедициналық зерттеулер. Дж Мед Генет. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Аналық эпигенетика және метил
қоспалар Avy/a тышқандарындағы агути генінің экспрессиясына әсер етеді. ФАСЕБ Дж.
1998; 12: 949 57.
39. Джиртл РЛ, Скиннер М.К. Қоршаған ортаның эпигеномикасы және ауруға бейімділігі.
Нат Рев Генет. 2007;8:253�62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Эпигенетикалық мұра
тышқандағы агути локусы. Нат Генет. 1999;23:314�8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Жыныстық эпигенетикалық
тышқанның A vy аллельінің тағамдық қоспалар арқылы модификациясы. Прок
Natl Acad Sci US A. 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Диеталық ақуыз
егеуқұйрықтарда F0 жүктілік кезінде шектеу трансгенерационды өзгерістерді тудырады
әйел ұрпақтарындағы бауыр транскриптомы. PLoS One. 2011;6, e21668.
43. Мультхауп М.Л., Селдин М.М., Джаффе А.Э., Лей Х, Киршнер Х, Мондал П және т.б. Тышқан адам
эксперименттік эпигенетикалық талдау диеталық мақсаттарды ашады және
диабеттік фенотиптерге генетикалық жауапкершілік. Жасуша метаб. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, т.б.
Эпигеномды жобалау және талдау бойынша ұсыныстар
ассоциациялық зерттеулер. Nat әдістері. 2013;10:949�55.
45. Дайех Т.А., Олссон А.Х., Волков П., Альмгрен П, Рюнн Т, Линг С.
2 типті қант диабетімен және дифференциалды ДНҚ метилденуімен байланысты CpG-SNP
адамның ұйқы безінің аралшықтарында. Қант диабеті. 2013;56:1036�46.
46. Relton CL, Davey Smith G. Екі сатылы эпигенетикалық Мендельдік рандомизация: а
жолдардағы эпигенетикалық процестердің себептік рөлін анықтау стратегиясы
ауруға. Int J Epidemiol. 2012;41:161�76.
47. Лю Ю, Арье М.Дж., Падюков Л, Фаллин MD, Хессельберг Е, Рунарссон А, т.б.
Эпигеномдық қауымдастық деректері ДНҚ метилденуін көрсетеді
ревматоидты артриттегі генетикалық қауіп делдал. Nat Biotechnol.
2013; 31: 142 7.
48. Юань В, Ся Ю, Белл СГ, Әйтсе де I, Феррейра Т, Уорд КДж, т.б. Біріктірілген
монозиготадағы 2 типті қант диабетіне сезімталдық локустарына эпигеномикалық талдау
егіздер. Nat Commun. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, т.б. Әсері а
бірінші дәрежелі қаңқа бұлшықетіндегі ДНҚ метилденуіне жаттығу араласуы
2 типті қант диабетімен ауыратын науқастардың туыстары. Қант диабеті. 2012;61:3322�32.
50. Гагнон Ф, Асси Д, Карри А, Моранж ПЭ, Трюгоут Д.А. сенімді растау
CPT1A локусындағы метилдену деңгейінің плазмадағы липидтердің деңгейімен байланысы.
J Lipid Res. 2014;55:1189�91.
51. Демерат Е.У., Гуан В, Гроув М.Л., Аслибекян С, Мендельсон М, Чжоу Ю.Х.,
т.б. BMI, BMI өзгерісі және эпигеномдық ассоцияциялық зерттеу (EWAS)
Африкандық американдық ересектердегі бел шеңбері бірнеше қайталануды анықтайды
локустар. Хум Мол Генет. 2015:ddv161�.
52. Дик КДж, Нельсон С.П., Цапроуни Л, Сандлинг Дж.К., Асси Д, Вал С, т.б. ДНҚ
метилдену және дене салмағының индексі: геномдық талдау. Лансет.
2014; 6736: 1 9.
53. Су С, Чжу Х, Сю Х, Ван Х, Дун Ы, Капуку Г, т.б. ДНҚ метилденуі
LY86 гені семіздікпен, инсулинге төзімділікпен және
қабыну. Twin Res Hum Genet. 2014;17:183�91.
54. Кларк-Харрис Р, Уилкин ТДж, Хоскинг Дж, Пинкни Дж, Джеффери А.Н., Меткалф БС, т.б.
PGC1? 5-7 жаста қандағы промотор метилденуі майдың пайда болуын болжайды
9-14 жас (EarlyBird 50). Қант диабеті. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L және т.б.
ADRB3 генінің қандағы және висцеральды майдағы ДНҚ метилденуінің промоторы
тіндер ерлердегі метаболикалық бұзылулармен байланысты. Эпигеномика.
2014; 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Семіздік – бұл
май тініндегі ДНҚ метилдену профилімен байланысты. Int J Epidemiol.
2014: 1-11.
57. Ирвин МР, Чжи Д, Джоханес Р, Мендельсон М, Аслибекян С, Клаас С.А., т.б.
Генетикадағы аш қарынға қан липидтерінің эпигеномдық ассоциациясын зерттеу
липидті төмендететін препараттар мен диеталар желісін зерттеу. Айналым. 2014;130:565�72.
58. Фрейзер-Вуд AC, Аслибекян С, Абшер Д.М., Хопкинс П.Н., Ша Дж., Цай М.Ю., т.б.
CPT1A локусындағы метилдену липопротеин субфракциясымен байланысты
профильдер. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, т.б. ДНҚ
липидтермен байланысты гендердің метилденуі қандағы липидтердің деңгейіне әсер етеді. Circ Cardiovasc
Генет. 2015.
60. Петерсен А.К., Зейлингер С, Кастенмюллер Г, Рәмиш-Маргл В, Брюггер М, Питерс
А, т.б. Эпигенетика метаболомикаға сәйкес келеді: эпигеномдық қауымдастық
қан сарысуының метаболикалық қасиеттерін зерттеу. Хум Мол Генет. 2014;23:534�45.
61. Хидалго Б, Ирвин МР, Ша Дж, Чжи Д, Аслибекян С, Абшер Д, т.б. Жалпы эпигеном
глюкозаның, инсулиннің және HOMA-IR-ның аштық өлшемдерінің ассоциациясын зерттеу
липидті төмендететін препараттардың генетикасында және диеталық желіні зерттеуде. Қант диабеті.
2014; 63: 801 7.
62. Dayeh T, Volkov P, Salï S, Hall E, Nilsson E, Olsson AH, et al. Геном бойынша
2 типті қант диабетімен ауыратын адамның ұйқы безі аралдарының ДНҚ метилдену талдауы
және диабеттік емес донорлар инсулинге әсер ететін кандидат гендерін анықтайды
секреция. PLoS Genet. 2014;10, e1004160.
63. Нилссон Е, Янсон П.А., Перфильев А, Волков П, Педерсен М, Свенссон М.К., т.б.
Өзгертілген ДНҚ метилденуі және әсер ететін гендердің дифференциалды экспрессиясы
2 типті субъектілердің майлы тіндеріндегі метаболизм және қабыну
қант диабеті. Қант диабеті. 2014;63:2962�76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, т.б. Адамның май тініндегі ДНҚ метилденуінің талдауы асқазанды айналып өтуге дейін және одан кейін семіздік гендерінің дифференциалды модификациясын және салмағын көрсетеді.
жоғалту. Ген. 2015;16:1�21.
65. Bateson P, Gluckman P. Дамудағы пластикалық және беріктік және
эволюция. Int J Epidemiol. 2012;41:219�23.
66. Фейнберг А.П., Айризарри Р.А., Фейнберг А.П., Иризарри Р.А. Денсаулықтағы эволюция және
медицина Саклер коллоквиумы: қозғаушы ретінде стохастикалық эпигенетикалық вариация
даму күші, эволюциялық бейімделу және ауру. Proc Natl Acad
Sci US A. 2010;107(Қосымша):1757�64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, т.б.
Туғаннан бастап егіздердегі ДНҚ метилденуінің бойлық, геномдық масштабтағы талдауы
18 айға дейін ерте өмірдегі және жұптық ерекшелікте жылдам эпигенетикалық өзгерістерді анықтайды
келіспеушілік салдары. Геном Биол. 2013;14:R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, т.б. ДНҚ
метилдену белгілері пренатальды аштық әсерін өсу мен байланыстырады
метаболизм. Nat Commun. 2014;5:5592.
69. Домингес-Салас П, Мур SE, Бейкер МС, Берген AW, Кокс SE, Дайер РА, т.б.
Жүктілік кезіндегі ананың тамақтануы адамның ДНҚ метилденуін модуляциялайды
метастабилді эпиаллельдер. Nat Commun. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, т.б.
Аналық гестациялық қант диабетінің ұрпақтарының метилдену үлгілеріне әсері
меллит және құрсақішілік өсуді тежеу жалпы гендерді болжайды және
кейінгі 2 типті қант диабеті қаупімен байланысты жолдар. FASEB J. 2014:1�12.
71. Моралес Е, күйеу А, Лоулор Д.А., Релтон КЛ. ДНҚ метилдену белгілері
Ананың гестациялық салмағының артуына байланысты сым қаны: нәтижесі
ALSPAC когорты. BMC Res жазбалары. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP және т.б.
Гестациялық қант диабеті эпигенетикалық түрде негізінен гендерге әсер етеді
зат алмасу ауруларына қатысады. Эпигенетика. 2013;8:935�43.
73. Лю Х, Чен Ц, Цай ХДж, Ван Г, Хун Х, Чжоу Ы, т.б. Аналық
туа біткен дене салмағының индексі және ұрпақ қанының ДНҚ-сы
метилдену: аурудың ерте өмірінің шығу тегін зерттеу. Environ Mol
Мутаген. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF және т.б.
Семіз ата-аналардың жаңа туған нәрестелерінде ДНҚ метилдену үлгілері өзгерді
таңбаланған гендер. Int J Obes (Лондия). 2015;39:650�7.
75. Джейкобсен SC, Брюнс С, Борк-Йенсен Дж, Рибел-Мадсен Р, Янг Б, Лара Е, т.б.
Қысқа мерзімді жоғары майлы тамақтандырудың геномдық ДНҚ-ға әсері
сау жас жігіттердің қаңқа бұлшықетіндегі метилдену. Қант диабеті.
2012; 55: 3341 9.
76. Гиллберг Л, Джейкобсен SC, Rïnn T, Brïns C, Vaag A. PPARGC1A ДНҚ
Салмағы төмен туылғандардағы тері астындағы май тінінде метилдену
5 күндік жоғары майлы тамақтандырудың әсері. Метаболизм. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Табысты салмақ жоғалтушылардың эпигенетикалық үлгілері: пилоттық зерттеу. Int J
Обес (Лондия). 2015;39:865�8.
78. Баррес Р, Киршнер Х, Расмуссен М, Ян Дж, Кантор ФР, Крук А, Нуслунд Е,
Зиерат Дж.Р. Адамның семіздігі кезінде асқазанды айналып өту операциясынан кейін салмақ жоғалту
промотордың метилденуін қалпына келтіреді. Ұяшық өкілі 2013:1�8.
79. Аренс М, Аммерполь О, фон Шэнфельс В, Коларова Дж, Бенс С, Ицель Т, т.б.
Алкогольсіз майлы бауыр ауруында ДНҚ метилдену талдауы көрсетеді
бариатриялық хирургиядан кейінгі ауруға тән және қайта құру белгілері.
Жасуша метаб. 2013;18:296�302.
80. Вуазин С, Эйнон Н, Ян Х, епископ диджейі. Жаттығу жаттығулары және ДНҚ метилденуі
адамдарда. Acta Physiol (Oxf). 2014;213:39�59.
81. Линдхолм ME, Марабита Ф, Гомес-Кабреро Д, Рундквист Х, Экстрем ТДЖ,
Тегнр Дж, т.б. Интегративті талдау үйлестірілген қайта бағдарламалауды көрсетеді
кейін адамның қаңқа бұлшықетіндегі эпигеном мен транскриптом
жаттығу. Эпигенетика. 2014;9:1557�69.
82. Денхэм Дж, ОБрайен Б.Дж., Маркес ФЗ, Чарчар Ф.Дж. Лейкоциттердегі өзгерістер
метилом және оның жаттығудан кейін жүрек-қан тамырларына қатысты гендерге әсері.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I және т.б.
Мультиомикалық біріктірілген желілер ДНҚ метилденуі мен миРНҚ-ны байланыстырады
2 типті диабеттік семіздікте созылмалы жаттығуларға қаңқа бұлшықетінің пластикасы.
Физиол геномикасы. 2014;46:747�65.
84. Хорват С, Эрхарт В, Брош М, Аммерполь О, фон Шонфельс В, Аренс М,
т.б. Семіздік адам бауырының эпигенетикалық қартаюын тездетеді. Proc Natl Acad
Ғылым. 2014;111:15538�43.
85. Альмин М.С., Нилссон Е.К., Джейкобссон Я.А., Калнина I, Кловинс Дж., Фредрикссон Р, т.б.
Геномды талдау әр түрлі болатын ДНҚ метилдену маркерлерін көрсетеді
жасы да, семіздігі де. Ген. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Анықтамасыз ұяшық қоспасын реттеу
ДНҚ метилдену деректерін талдауда. Биоинформатика. 2014;30:1431�9.
87. Wells JC. Болжамды бейімделу реакциясының гипотезасын сыни бағалау.
Int J Epidemiol. 2012;41:229�35.
88. Уильямс-Висс О, Чжан С, Маклафлин С.М., Климан Д, Уокер СК, Сутер
CM және т.б. Эмбрион саны және периконцепциялық жеткіліксіз тамақтану
қойдың бүйрек үсті безінің эпигенотипіне, өсуіне және дифференциалды әсері бар
даму. Am J Physiol Endocrinol Metab. 2014;307:E141�50.
89. Чжан С, Ратанатрей Л, Моррисон Дж.Л., Николас Л.М., Ли С, МакМиллен IC.
Ананың семіздігі және балалық семіздіктің ерте пайда болуы: салмақ
периконцепциялық кезеңде ананың салмағын жоғалтудың пайдасы мен шығындары
ұрпақ үшін кезең. Exp Diabetes Res. 2011;2011:585749.
90. Чжан С, Уильямс-Висс О, Маклафлин С.М., Уокер СК, Климан ДО, Сутер
CM және т.б. Тұжырымдамадан кейінгі бірінші аптада ананың жеткіліксіз тамақтануы
глюкокортикоидты рецепторлардың мРНҚ экспрессиясының төмендеуіне әкеледі
кеш кезеңде ұрықтың гипофизінде GR экзон 17 гиперметиляциясының болмауы
жүктілік. J Dev Orig Heal Dis. 2013;4:391�401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
т.б. Периконцепциялық жеткіліксіз тамақтану бағдарламалары инсулин сигналындағы өзгерістер
жалғыз және егіз ұрықтың қаңқа бұлшықетіндегі молекулалар мен микроРНҚ
қой. Биол Репрод. 2014;90:5.
92. Ван Стратен Е.М., ван Меер Х, Хуйкман NC, ван Дейк Т.Х., Баллер Дж.Ф., Веркаде
HJ, т.б. Ұрықтың бауыры X рецепторларының активтенуі липогенезді жедел индукциялайды, бірақ
ересек тышқандардағы майы жоғары диетаға плазманың липидті реакциясына әсер етпейді. Мен Дж
Физиол эндокринол метаб. 2009;297:E1171�8.
93. Фернандес-Твинн ДС, Альфарадхи МЗ, Мартин-Гронерт М.С., Дуке-Гимараес
DE, Piekarz A, Ferland-McCollough D және т.б. IRS-1 режимін төмендету
семіз тышқандардың ұрпақтарының майлы тіндері целлутономды түрде бағдарламаланған
посттранскрипциялық механизмдер арқылы. Мол Метаб.
2014; 3: 325 33.
94. Waterland RA, Travisano M, Tahiliani KG. Диеталық гиперметиляция кезінде
agouti өміршең сары ұрғашы арқылы тұқым қуаламайды.
FASEB J. 2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, т.б. ДНҚ метилденуі
аналық тышқандардың жұмыртқа жасушалары мен бауыры және олардың ұрпақтары: жоғары майлы диеталық әсерлер
семіздік. Env Heal Perspect. 2014;122:159�64.
96. Олликайнен М, Исмаил К, Гервин К, Килленен А, Хаккарайнен А, Лундбом Дж, т.б.
Реттеуші элементтердегі геномдық қан ДНҚ метилдену өзгерістері
және семіздікке сәйкес келмейтін монозиготикалық егіздердегі гетерохроматикалық аймақтар
және бауыр майы. Клиникалық эпигенетика. 2015; 7: 1 13.








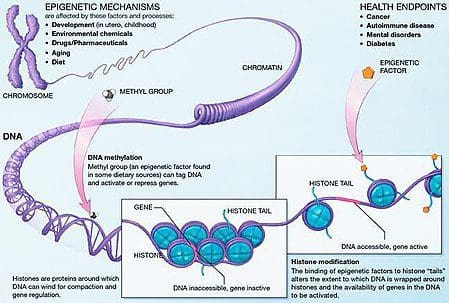 Семіздік - кешенді, көп факторлы ауру және өмір салты, қоршаған орта мен генетика арасындағы өзара әрекеттестіктің негізінде жатқан механизмдерді жақсырақ түсіну, алдын алу және емдеудің тиімді стратегияларын әзірлеу үшін маңызды [1].
Семіздік - кешенді, көп факторлы ауру және өмір салты, қоршаған орта мен генетика арасындағы өзара әрекеттестіктің негізінде жатқан механизмдерді жақсырақ түсіну, алдын алу және емдеудің тиімді стратегияларын әзірлеу үшін маңызды [1]. Жануарлар үлгілері қазіргі метаболикалық күйдің көрсеткіштері ретінде де, семіздік пен метаболикалық аурудың болашақ қаупін болжаушылар ретінде де нақты эпигенетикалық белгілердің рөлі туралы механикалық түсінік беретін жоғары бақыланатын зерттеулерге бірегей мүмкіндіктер береді. Жануарларды зерттеудің ерекше маңызды аспектісі - олар мақсатты тіндердегі, соның ішінде бауыр мен гипоталамустағы эпигенетикалық өзгерістерді бағалауға мүмкіндік береді, бұл адамдарда әлдеқайда қиын. Сонымен қатар, жаңа тіндердің көп мөлшерін жинау мүмкіндігі көптеген хроматин белгілерін, сондай-ақ ДНҚ метилденуін бағалауға мүмкіндік береді. Осы эпигенетикалық модификациялардың кейбірі жеке немесе біріктірілген түрде қоршаған ортаны бағдарламалауға жауап беруі мүмкін. Жануарлар үлгілерінде ұрпақтардың бірнеше ұрпағын зерттеуге болады және осылайша адам зерттеулерінде оңай ажыратылмайтын ата-ананың тамақтану статусының эпигенетикалық жады арқылы семіздік қаупінің ұрпақаралық және ұрпақ аралық берілуін саралауға мүмкіндік береді. Біз бірінші терминді мейоздық қауіп-қатердің берілуінің жалғасуы болмаған кезде қолданамыз, ал соңғысы, ең алдымен, ұрықтың немесе гаметалардың метаболикалық қайта бағдарламалануы арқылы тәуекелдің тікелей берілуін талап етеді.
Жануарлар үлгілері қазіргі метаболикалық күйдің көрсеткіштері ретінде де, семіздік пен метаболикалық аурудың болашақ қаупін болжаушылар ретінде де нақты эпигенетикалық белгілердің рөлі туралы механикалық түсінік беретін жоғары бақыланатын зерттеулерге бірегей мүмкіндіктер береді. Жануарларды зерттеудің ерекше маңызды аспектісі - олар мақсатты тіндердегі, соның ішінде бауыр мен гипоталамустағы эпигенетикалық өзгерістерді бағалауға мүмкіндік береді, бұл адамдарда әлдеқайда қиын. Сонымен қатар, жаңа тіндердің көп мөлшерін жинау мүмкіндігі көптеген хроматин белгілерін, сондай-ақ ДНҚ метилденуін бағалауға мүмкіндік береді. Осы эпигенетикалық модификациялардың кейбірі жеке немесе біріктірілген түрде қоршаған ортаны бағдарламалауға жауап беруі мүмкін. Жануарлар үлгілерінде ұрпақтардың бірнеше ұрпағын зерттеуге болады және осылайша адам зерттеулерінде оңай ажыратылмайтын ата-ананың тамақтану статусының эпигенетикалық жады арқылы семіздік қаупінің ұрпақаралық және ұрпақ аралық берілуін саралауға мүмкіндік береді. Біз бірінші терминді мейоздық қауіп-қатердің берілуінің жалғасуы болмаған кезде қолданамыз, ал соңғысы, ең алдымен, ұрықтың немесе гаметалардың метаболикалық қайта бағдарламалануы арқылы тәуекелдің тікелей берілуін талап етеді.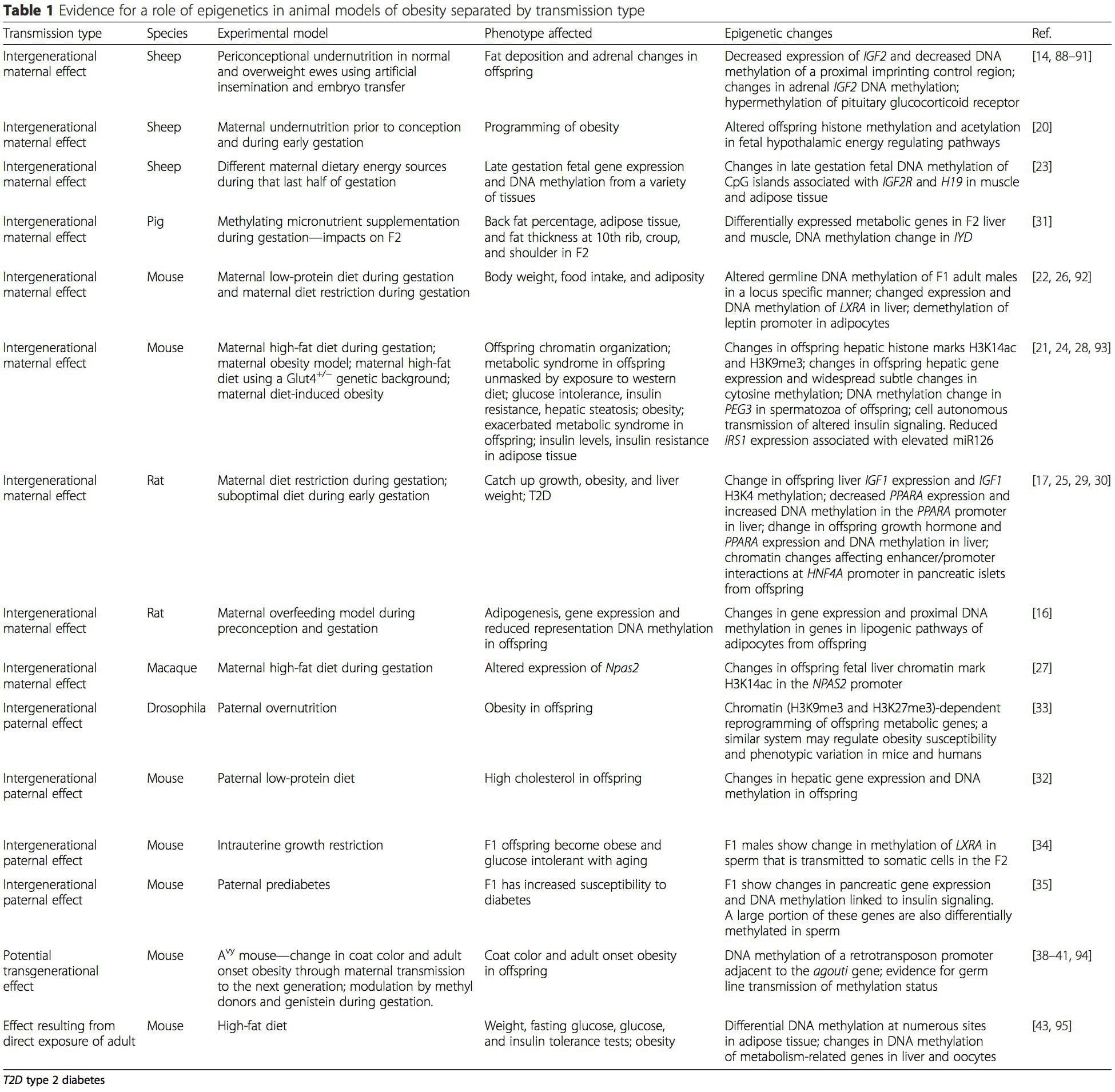 (i) Гемация кезінде ананың тамақтануымен байланысты ұрықтың эпигенетикалық өзгерістері
(i) Гемация кезінде ананың тамақтануымен байланысты ұрықтың эпигенетикалық өзгерістері Жүктілік кезіндегі ананың тағамдық қоспалары, жеткіліксіз тамақтануы және шамадан тыс тамақтануы ұрпақтардағы майдың жиналуын және энергия гомеостазын өзгертуі мүмкін [11, 13-15, 19]. Ұрпақтағы бұл әсерлермен байланысты ДНҚ метилденуіндегі өзгерістер, гистонның трансляциядан кейінгі модификациялары және бірнеше мақсатты гендер үшін ген экспрессиясы, әсіресе май қышқылының метаболизмін және инсулин сигналын реттейтін гендер [16, 17, 20-30]. Осы зерттеулерде пайдаланылған жануарлар үлгілерінің әртүрлілігі және әсер ететін жалпы метаболикалық жолдар эпигенетикалық модификация арқылы болатын эволюциялық сақталған бейімделу реакциясын көрсетеді. Дегенмен, белгілі бір анықталған гендер мен эпигенетикалық өзгерістердің аз бөлігі тиісті зерттеулерде кросс-валиденді және кең ауқымды геномдық зерттеулер әдетте қолданылмаған. Бұл зерттеулерді салыстырудағы негізгі кедергі - айтарлықтай әртүрлі нәтижелерді тудыруы мүмкін қоректік қиындықтарға ұшыраған психикалық дамудың әртүрлі терезелері. Эпигенетикалық өзгерістер ұрпақтың фенотиптік өзгерістерімен байланысты емес, себеп-салдарлы екенін дәлелдеу де қажет. Бұл ұрпақтардағы өзгерген фенотиптің дамуының алдында ата-ананың қоректенетін эпигенетикалық «есте сақтау» реакциясын анықтауды қажет етеді.
Жүктілік кезіндегі ананың тағамдық қоспалары, жеткіліксіз тамақтануы және шамадан тыс тамақтануы ұрпақтардағы майдың жиналуын және энергия гомеостазын өзгертуі мүмкін [11, 13-15, 19]. Ұрпақтағы бұл әсерлермен байланысты ДНҚ метилденуіндегі өзгерістер, гистонның трансляциядан кейінгі модификациялары және бірнеше мақсатты гендер үшін ген экспрессиясы, әсіресе май қышқылының метаболизмін және инсулин сигналын реттейтін гендер [16, 17, 20-30]. Осы зерттеулерде пайдаланылған жануарлар үлгілерінің әртүрлілігі және әсер ететін жалпы метаболикалық жолдар эпигенетикалық модификация арқылы болатын эволюциялық сақталған бейімделу реакциясын көрсетеді. Дегенмен, белгілі бір анықталған гендер мен эпигенетикалық өзгерістердің аз бөлігі тиісті зерттеулерде кросс-валиденді және кең ауқымды геномдық зерттеулер әдетте қолданылмаған. Бұл зерттеулерді салыстырудағы негізгі кедергі - айтарлықтай әртүрлі нәтижелерді тудыруы мүмкін қоректік қиындықтарға ұшыраған психикалық дамудың әртүрлі терезелері. Эпигенетикалық өзгерістер ұрпақтың фенотиптік өзгерістерімен байланысты емес, себеп-салдарлы екенін дәлелдеу де қажет. Бұл ұрпақтардағы өзгерген фенотиптің дамуының алдында ата-ананың қоректенетін эпигенетикалық «есте сақтау» реакциясын анықтауды қажет етеді. Жаңа туындайтын зерттеулер көрсеткендей, тамақтану ата-анасының ұрпағы майдың тұнуы мен эпигенетикалық белгілеріне әсер етуі мүмкін [31 34]. Тышқандарды қолданған жақында жүргізілген бір зерттеу көрсеткендей, әке алдындағы диабет F1 ұрпақтарында қант диабетіне сезімталдықтың ұйқы безі гендерінің экспрессиясындағы өзгерістермен және инсулин сигнализациясымен байланысты ДНҚ метиляциясымен бірге жүреді [35]. Маңыздысы, панкреатикалық аралдар мен ұрықтарда эпигенетикалық өзгерістердің қабаттасуы болды, бұл ұрық жолдарының тұқым қуалауын болжайды. Алайда, бұл зерттеулердің көпшілігі, салдары бойынша қызықты болса да, тергеудің геномдық ауқымында шектеулі және ұрпақтардағы жұмсақ метаболикалық фенотиптермен байланысты әлсіз және біршама уақытша эпигенетикалық өзгерістерді көрсетеді.
Жаңа туындайтын зерттеулер көрсеткендей, тамақтану ата-анасының ұрпағы майдың тұнуы мен эпигенетикалық белгілеріне әсер етуі мүмкін [31 34]. Тышқандарды қолданған жақында жүргізілген бір зерттеу көрсеткендей, әке алдындағы диабет F1 ұрпақтарында қант диабетіне сезімталдықтың ұйқы безі гендерінің экспрессиясындағы өзгерістермен және инсулин сигнализациясымен байланысты ДНҚ метиляциясымен бірге жүреді [35]. Маңыздысы, панкреатикалық аралдар мен ұрықтарда эпигенетикалық өзгерістердің қабаттасуы болды, бұл ұрық жолдарының тұқым қуалауын болжайды. Алайда, бұл зерттеулердің көпшілігі, салдары бойынша қызықты болса да, тергеудің геномдық ауқымында шектеулі және ұрпақтардағы жұмсақ метаболикалық фенотиптермен байланысты әлсіз және біршама уақытша эпигенетикалық өзгерістерді көрсетеді.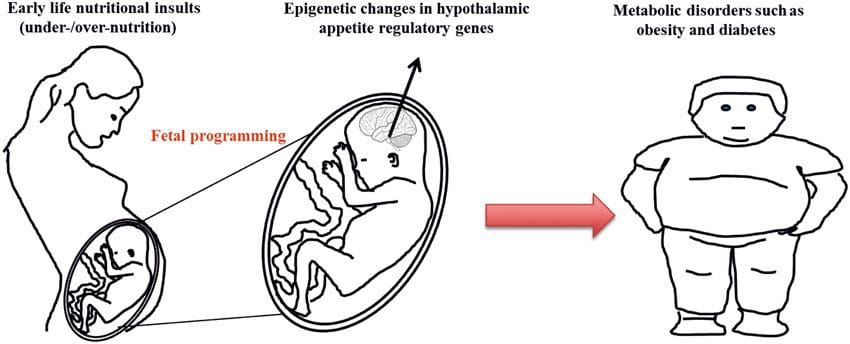 Эпигенетикалық ақпараттың бірнеше ұрпақтарда тұрақты берілуі өсімдік жүйелерінде және С-да жақсы сипатталған. elegans, бірақ оның сүтқоректілердегі маңызы әлі де көп талқылануда [36, 37]. Диеталық әсерге жауап ретінде фенотиптердің ата-бабадан берілуінің эпигенетикалық негізі, соның ішінде мал түрлерінде жақсы анықталған [31]. Ұрпақ фенотипіне әсер ететін эпигенетикалық беріліс әсерін көрсететін ең ықпалды зерттеулер өміршең сары агути (Avy) тышқанының мысалын пайдаланды [38]. Бұл тінтуірде агути генінен жоғары қарай ретротранспозонды енгізу оның конститутивтік экспрессиясын және нәтижесінде сары жабын түсін және ересек адамның семіздігін тудырады. Ананың ұрық желісі арқылы берілуі ДНҚ метилденуі арқылы агути экспрессиясының дыбыссыздануына әкеледі, нәтижесінде жабайы типтегі пальто түсі мен ұрпақтың арық фенотипі пайда болады [39, 40]. Маңыздысы, осы тышқандардағы кейінгі зерттеулер ананың метил донорларының әсері пальто түсінің өзгеруіне әкелетінін көрсетті [41]. Бір зерттеу фенотиптің F3 ұрпаққа берілуін және F0 [42] ақуыз шектеуіне жауап ретінде гендердің көп санының экспрессиясының өзгеруін хабарлады; дегенмен экспрессиядағы өзгерістер өте өзгермелі болды және бұл жүйеде эпигенетикалық өзгерістерге тікелей байланыс анықталмады.
Эпигенетикалық ақпараттың бірнеше ұрпақтарда тұрақты берілуі өсімдік жүйелерінде және С-да жақсы сипатталған. elegans, бірақ оның сүтқоректілердегі маңызы әлі де көп талқылануда [36, 37]. Диеталық әсерге жауап ретінде фенотиптердің ата-бабадан берілуінің эпигенетикалық негізі, соның ішінде мал түрлерінде жақсы анықталған [31]. Ұрпақ фенотипіне әсер ететін эпигенетикалық беріліс әсерін көрсететін ең ықпалды зерттеулер өміршең сары агути (Avy) тышқанының мысалын пайдаланды [38]. Бұл тінтуірде агути генінен жоғары қарай ретротранспозонды енгізу оның конститутивтік экспрессиясын және нәтижесінде сары жабын түсін және ересек адамның семіздігін тудырады. Ананың ұрық желісі арқылы берілуі ДНҚ метилденуі арқылы агути экспрессиясының дыбыссыздануына әкеледі, нәтижесінде жабайы типтегі пальто түсі мен ұрпақтың арық фенотипі пайда болады [39, 40]. Маңыздысы, осы тышқандардағы кейінгі зерттеулер ананың метил донорларының әсері пальто түсінің өзгеруіне әкелетінін көрсетті [41]. Бір зерттеу фенотиптің F3 ұрпаққа берілуін және F0 [42] ақуыз шектеуіне жауап ретінде гендердің көп санының экспрессиясының өзгеруін хабарлады; дегенмен экспрессиядағы өзгерістер өте өзгермелі болды және бұл жүйеде эпигенетикалық өзгерістерге тікелей байланыс анықталмады. Көптеген зерттеулерде кандидаттық аймаққа тәуелді аймақтарды пайдаланып, жануарлардың үлгілерінде диетаға байланысты эпигенетикалық өзгерістер анықталғанымен, геномдық ауқымды талдау жүргізілді. Жақында өткізілген зерттеу геномдық-кеңейтілген геннің экспрессиясын және ДНҚ-ны метилирования талдауын қолдану арқылы ересек тышқандарда жоғары майлы диеталар / диетаның индукцияланған семіздікінің тікелей эпигенетикалық әсерін анықтауға бағытталған [43]. Бұл зерттеу бақылау мен жоғары майланған тышқандардан алынған адипоциттердегі 232 дифференциалды метилированные аймақтарды (DMR) анықтады. Маңыздысы бойынша, морфологиялық DMR-лерге арналған тиісті адамдық аймақтар да семіздік пен нәзік адамдардың популяциясынан майдың тініне дифференциалды түрде метилленді, осылайша бұл аймақтардың тамаша эволюциялық сақталуын ерекше атап өтті. Бұл нәтиже сүтқоректілердің энергетикалық гомеостазасын реттеуде анықталған DMR-дың ықтимал маңыздылығын көрсетеді.
Көптеген зерттеулерде кандидаттық аймаққа тәуелді аймақтарды пайдаланып, жануарлардың үлгілерінде диетаға байланысты эпигенетикалық өзгерістер анықталғанымен, геномдық ауқымды талдау жүргізілді. Жақында өткізілген зерттеу геномдық-кеңейтілген геннің экспрессиясын және ДНҚ-ны метилирования талдауын қолдану арқылы ересек тышқандарда жоғары майлы диеталар / диетаның индукцияланған семіздікінің тікелей эпигенетикалық әсерін анықтауға бағытталған [43]. Бұл зерттеу бақылау мен жоғары майланған тышқандардан алынған адипоциттердегі 232 дифференциалды метилированные аймақтарды (DMR) анықтады. Маңыздысы бойынша, морфологиялық DMR-лерге арналған тиісті адамдық аймақтар да семіздік пен нәзік адамдардың популяциясынан майдың тініне дифференциалды түрде метилленді, осылайша бұл аймақтардың тамаша эволюциялық сақталуын ерекше атап өтті. Бұл нәтиже сүтқоректілердің энергетикалық гомеостазасын реттеуде анықталған DMR-дың ықтимал маңыздылығын көрсетеді.
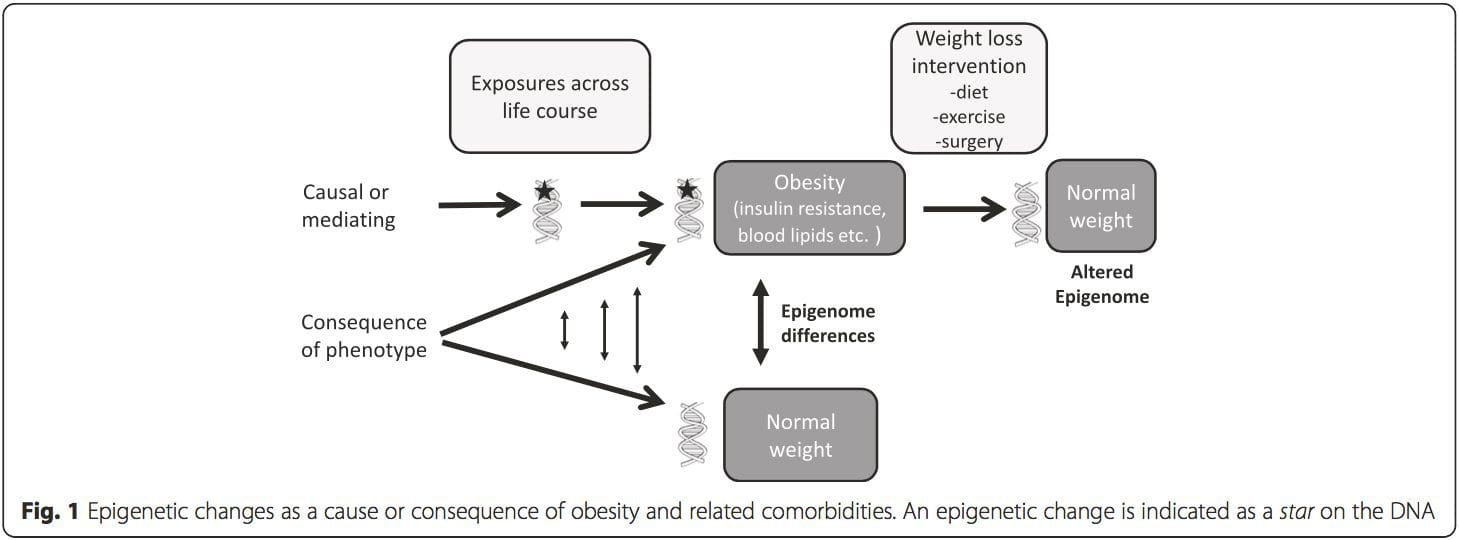 i) Генетикалық қауымдастықтың зерттеуі. Белгілі бір жағдайлардың даму қаупінің жоғарылауымен байланысты генетикалық полиморфизмдер қоздырғыш гендермен априори байланысты. Мұндай аймақтарда дифференциал-метиляцияның болуы осы эпигенетикалық өзгерістердің проксимальды гендердің экспрессиясын басқарудағы функционалдық маңыздылығын көрсетеді. Көптеген эпигенетикалық вариацияға негізделген күшті cis-әрекет ететін генетикалық әсерлер бар [7, 45] және популяцияға негізделген зерттеулерде эпигеномдық айырмашылықтардың себепті немесе делдалдық рөлін анықтау үшін генетикалық суррогаттарды пайдаланатын әдістер қолданылған [7, 46-48] . Отбасылық генетикалық ақпаратты пайдалану сонымен қатар фенотипке байланысты дифференциалды метилденуді көрсететін ықтимал себепші кандидат аймақтарды анықтауға әкелуі мүмкін [49].
i) Генетикалық қауымдастықтың зерттеуі. Белгілі бір жағдайлардың даму қаупінің жоғарылауымен байланысты генетикалық полиморфизмдер қоздырғыш гендермен априори байланысты. Мұндай аймақтарда дифференциал-метиляцияның болуы осы эпигенетикалық өзгерістердің проксимальды гендердің экспрессиясын басқарудағы функционалдық маңыздылығын көрсетеді. Көптеген эпигенетикалық вариацияға негізделген күшті cis-әрекет ететін генетикалық әсерлер бар [7, 45] және популяцияға негізделген зерттеулерде эпигеномдық айырмашылықтардың себепті немесе делдалдық рөлін анықтау үшін генетикалық суррогаттарды пайдаланатын әдістер қолданылған [7, 46-48] . Отбасылық генетикалық ақпаратты пайдалану сонымен қатар фенотипке байланысты дифференциалды метилденуді көрсететін ықтимал себепші кандидат аймақтарды анықтауға әкелуі мүмкін [49].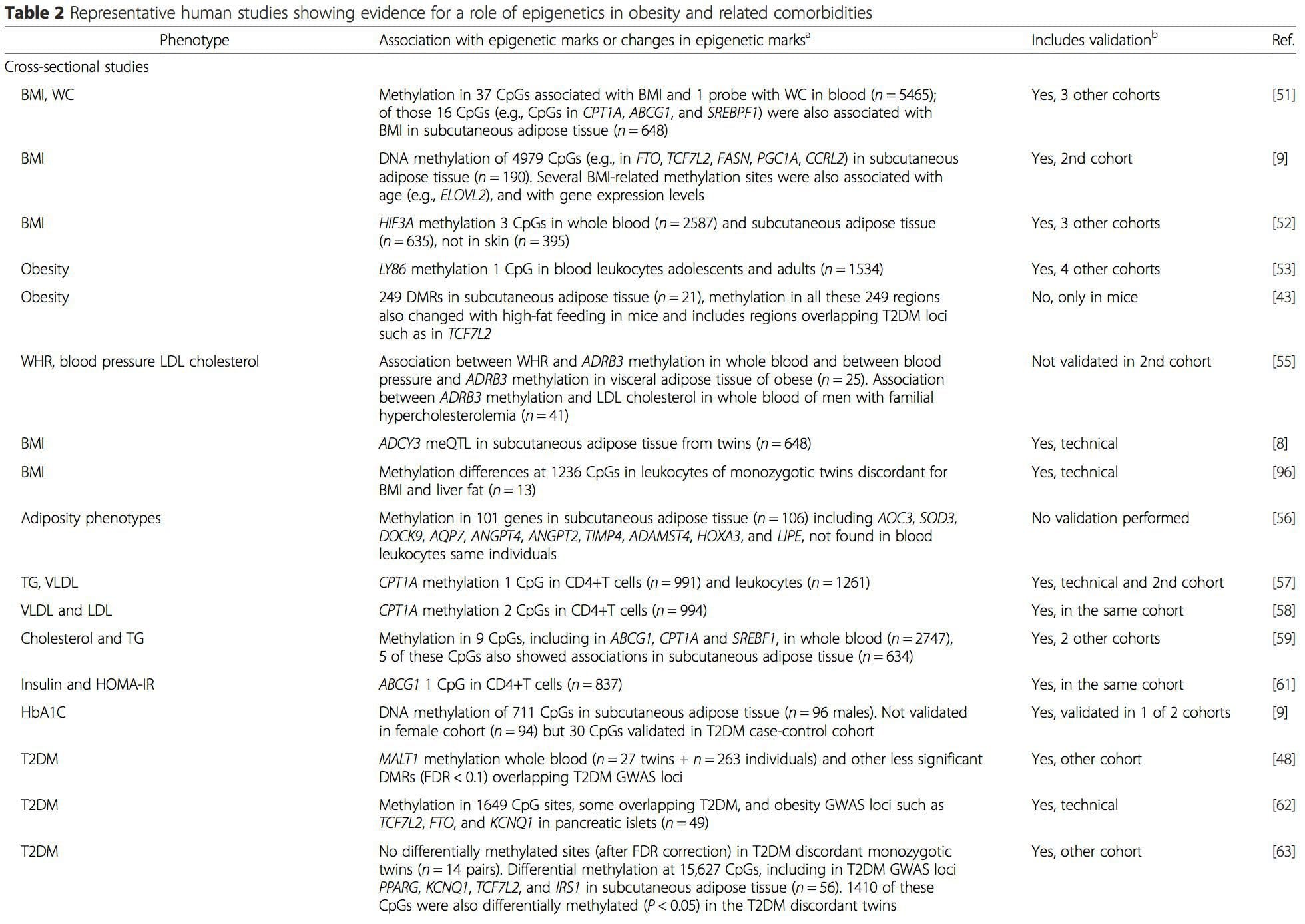
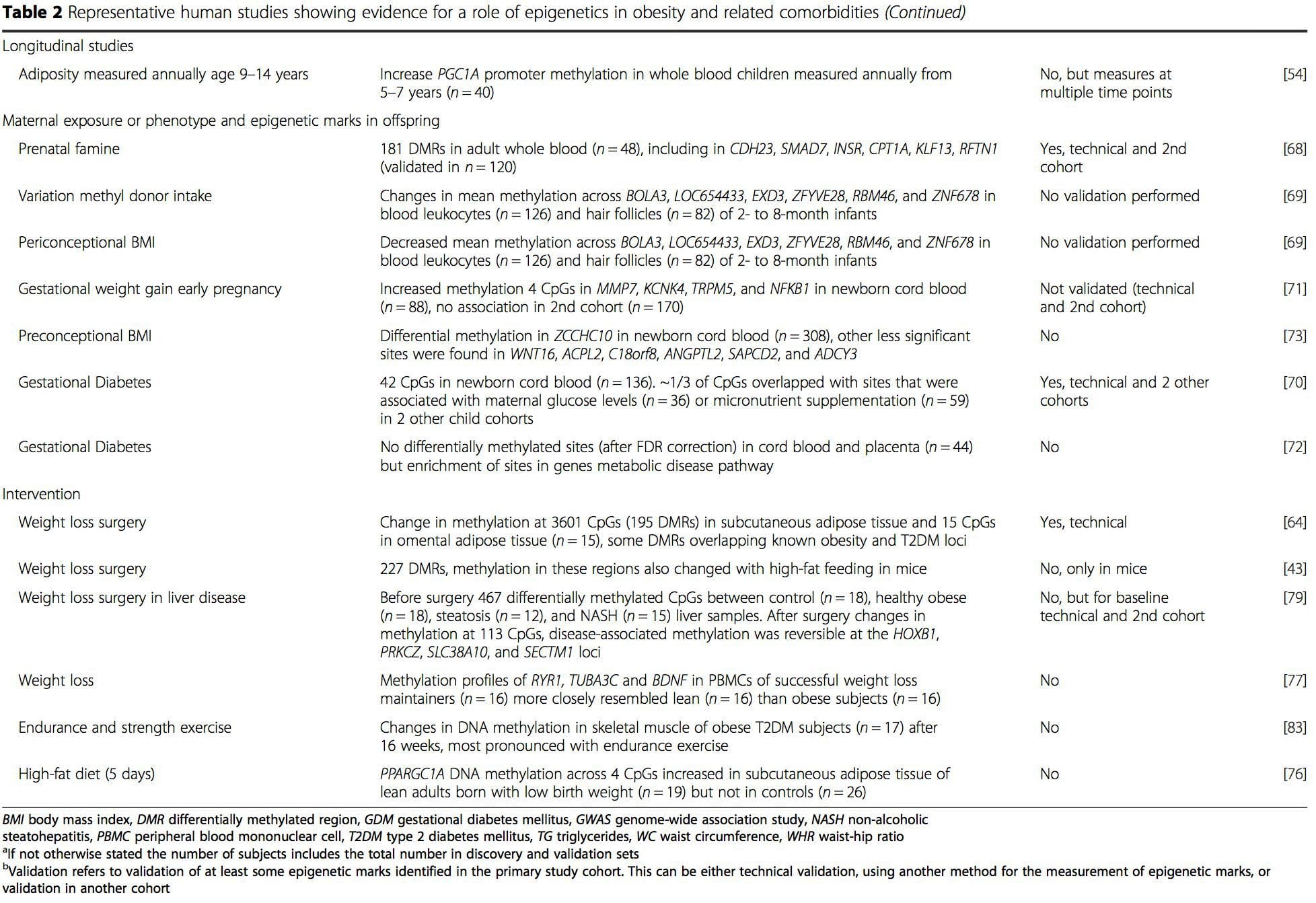 Осы зерттеулерден бастап, PGC1A, HIF3A, ABCG1 және CPT1A және бұрын сипатталған RXRA [18] метиллануының метаболизм метаболизмі, метаболизмге байланысты метаболизмге байланысты, немесе, мүмкін, метаболизмдік аурулардың дамуында рөлі бар үміткерлер болып табылатын биомаркерлер ретінде пайда болды. .
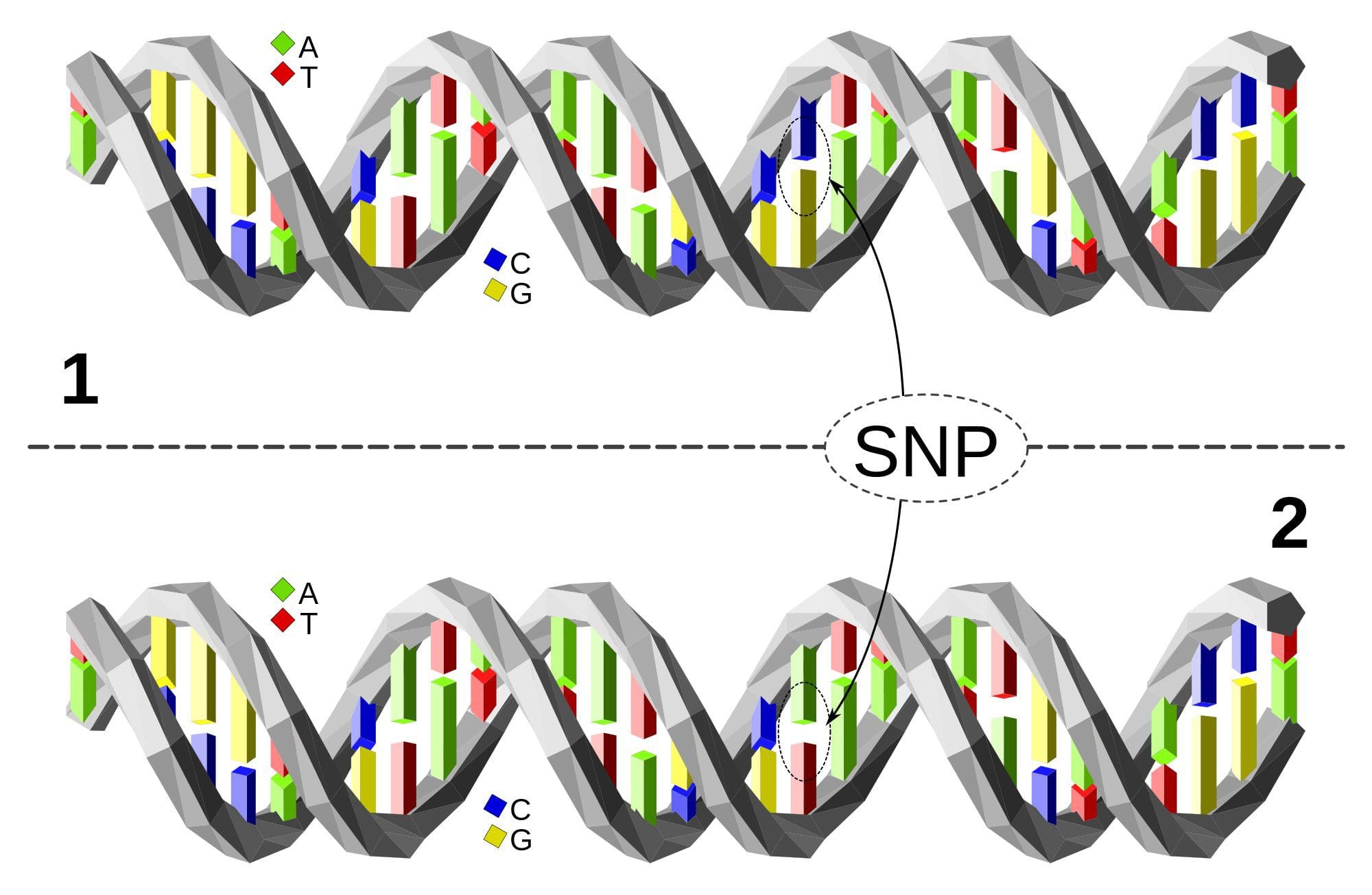
Осы зерттеулерден бастап, PGC1A, HIF3A, ABCG1 және CPT1A және бұрын сипатталған RXRA [18] метиллануының метаболизм метаболизмі, метаболизмге байланысты метаболизмге байланысты, немесе, мүмкін, метаболизмдік аурулардың дамуында рөлі бар үміткерлер болып табылатын биомаркерлер ретінде пайда болды. .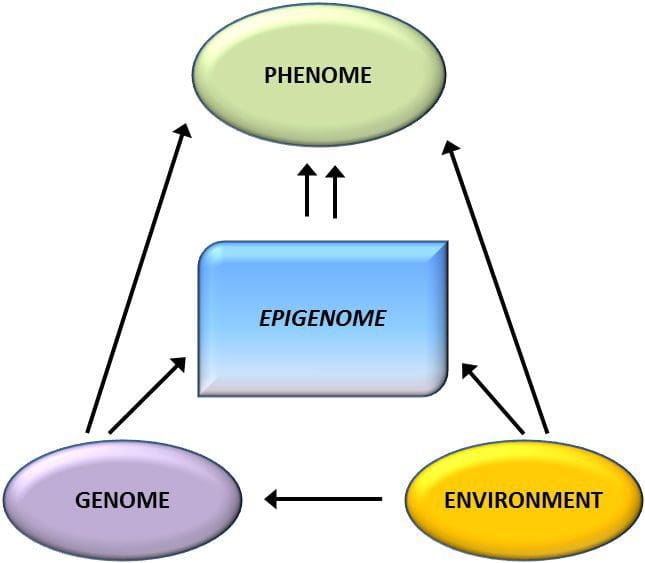 Эпигенетикалық вариацияға негізгі генетикалық вариация қатты әсер етеді, генотип вариацияның ~20-40% түсіндіреді [6, 8]. Жақында бірқатар зерттеулер аурудың фенотиптерімен байланысты метилденудің сандық локустарын (meQTL) анықтау үшін метилом және генотип деректерін біріктіре бастады. Мысалы, май тінінде ADCY3 жоғары ағынындағы күшейткіш элементте BMI генетикалық қауіп локусымен қабаттасатын meQTL анықталды [8]. Басқа зерттеулер сонымен қатар белгілі семіздік пен T2DM тәуекел локустары мен семіздік пен T2DM-мен байланысты DMRs арасындағы сәйкестіктерді анықтады [43, 48, 62]. Мұндай DMR бірқатарының метилденуі тышқандарды жоғары маймен тамақтандыру [43] және адамдардағы салмақ жоғалту [64] арқылы модуляцияланған. Бұл нәтижелер ауруға бейімділікке байланысты генетикалық вариациялар мен олардың тамақтану қиындықтарына жауап ретінде эпигенетикалық модификациялардан өтетін геном аймақтарымен байланысы арасындағы қызықты байланысты анықтайды, бұл себепті байланысты білдіреді. Генетикалық және эпигенетикалық вариация арасындағы тығыз байланыс олардың жеке вариацияны тудырудағы маңызды рөлдерін білдіруі мүмкін [65, 66]. Дегенмен, бұл тұжырымдар ДНҚ метилденуі генетикалық әсерлердің медиаторы болуы мүмкін екенін көрсетсе де, генетикалық және эпигенетикалық процестер бір гендерде тәуелсіз әрекет ете алатынын ескеру маңызды. Егіздік зерттеулер [8, 63, 67] маңызды түсініктерді бере алады және ДНҚ метилдену деңгейлеріндегі жеке аралық айырмашылықтар негізінен ортақ емес ортадан және стохастикалық әсерлерден, ең азы ортақ қоршаған орта әсерінен, сонымен бірге генетикалық вариация.
Эпигенетикалық вариацияға негізгі генетикалық вариация қатты әсер етеді, генотип вариацияның ~20-40% түсіндіреді [6, 8]. Жақында бірқатар зерттеулер аурудың фенотиптерімен байланысты метилденудің сандық локустарын (meQTL) анықтау үшін метилом және генотип деректерін біріктіре бастады. Мысалы, май тінінде ADCY3 жоғары ағынындағы күшейткіш элементте BMI генетикалық қауіп локусымен қабаттасатын meQTL анықталды [8]. Басқа зерттеулер сонымен қатар белгілі семіздік пен T2DM тәуекел локустары мен семіздік пен T2DM-мен байланысты DMRs арасындағы сәйкестіктерді анықтады [43, 48, 62]. Мұндай DMR бірқатарының метилденуі тышқандарды жоғары маймен тамақтандыру [43] және адамдардағы салмақ жоғалту [64] арқылы модуляцияланған. Бұл нәтижелер ауруға бейімділікке байланысты генетикалық вариациялар мен олардың тамақтану қиындықтарына жауап ретінде эпигенетикалық модификациялардан өтетін геном аймақтарымен байланысы арасындағы қызықты байланысты анықтайды, бұл себепті байланысты білдіреді. Генетикалық және эпигенетикалық вариация арасындағы тығыз байланыс олардың жеке вариацияны тудырудағы маңызды рөлдерін білдіруі мүмкін [65, 66]. Дегенмен, бұл тұжырымдар ДНҚ метилденуі генетикалық әсерлердің медиаторы болуы мүмкін екенін көрсетсе де, генетикалық және эпигенетикалық процестер бір гендерде тәуелсіз әрекет ете алатынын ескеру маңызды. Егіздік зерттеулер [8, 63, 67] маңызды түсініктерді бере алады және ДНҚ метилдену деңгейлеріндегі жеке аралық айырмашылықтар негізінен ортақ емес ортадан және стохастикалық әсерлерден, ең азы ортақ қоршаған орта әсерінен, сонымен бірге генетикалық вариация. Пренаталдық орта: Жақында жарияланған екі зерттеуде аналық жүктіліктің жүктілікке дейінгі немесе жүктілік кезіндегі ұрпақтардың ДНҚ метилденуіне әсерін зерттеу үшін қоректік заттардың табиғи өзгеруіне ұшыраған адам популяциясы қолданылды [68, 69]. Бірінші зерттеуде Гамбиялық ана мен бала когорты қолданылып, жүктілік кезінде ана метил донорларын қабылдаудың маусымдық өзгерістері де, аналардың жүктілікке дейінгі BMI де нәрестелердегі метилирлеудің өзгеруіне байланысты болды [69]. Екінші зерттеу голландиялық Hunger Winter когортасынан ересек ұрпақтың өсу мен метаболизмге қатысатын гендердің ДНҚ метилденуіне ананың ауыр тамақтанбауының өткір кезеңіне пренатальды әсер етуінің әсерін зерттеу үшін пайдаланды [68]. Нәтижелер әсер ету уақытының оның эпигеномға әсер етудегі маңыздылығын көрсетті, өйткені эпигенетикалық маңызды әсерлер тек жүктіліктің ерте кезеңінде аштыққа ұшыраған адамдарда ғана анықталды. Маңыздысы, эпигенетикалық өзгерістер BMI жоғарылауымен қатар жүрді; дегенмен, бұл зерттеуде бұл өзгерістер өмірде бұрын болғанын немесе BMI деңгейінің жоғарылауының салдарын анықтау мүмкін болмады.
Пренаталдық орта: Жақында жарияланған екі зерттеуде аналық жүктіліктің жүктілікке дейінгі немесе жүктілік кезіндегі ұрпақтардың ДНҚ метилденуіне әсерін зерттеу үшін қоректік заттардың табиғи өзгеруіне ұшыраған адам популяциясы қолданылды [68, 69]. Бірінші зерттеуде Гамбиялық ана мен бала когорты қолданылып, жүктілік кезінде ана метил донорларын қабылдаудың маусымдық өзгерістері де, аналардың жүктілікке дейінгі BMI де нәрестелердегі метилирлеудің өзгеруіне байланысты болды [69]. Екінші зерттеу голландиялық Hunger Winter когортасынан ересек ұрпақтың өсу мен метаболизмге қатысатын гендердің ДНҚ метилденуіне ананың ауыр тамақтанбауының өткір кезеңіне пренатальды әсер етуінің әсерін зерттеу үшін пайдаланды [68]. Нәтижелер әсер ету уақытының оның эпигеномға әсер етудегі маңыздылығын көрсетті, өйткені эпигенетикалық маңызды әсерлер тек жүктіліктің ерте кезеңінде аштыққа ұшыраған адамдарда ғана анықталды. Маңыздысы, эпигенетикалық өзгерістер BMI жоғарылауымен қатар жүрді; дегенмен, бұл зерттеуде бұл өзгерістер өмірде бұрын болғанын немесе BMI деңгейінің жоғарылауының салдарын анықтау мүмкін болмады. Босанғаннан кейінгі орта: Эпигеном эмбриональды даму кезеңінде де-ново түрінде орнатылады, сондықтан пренатальды орта эпигеномға айтарлықтай әсер етеді. Алайда, қазіргі кезде қартаю, токсиндердің әсерінен және диеталық өзгерістерден тұратын көптеген жағдайлардың әсерінен «жетілген» эпигеномда өзгерістер болатыны анық. Мысалы, қаңқа бұлшықетіндегі көптеген гендердегі ДНҚ метилденуінің өзгеруі және май тіндеріндегі PGC1A майлы тамақтануға жауап ретінде көрсетілген [75, 76]. Денедегі майдың массасын жоғалтуға арналған араласулар ДНҚ метилденуінің өзгеруімен де байланысты болды. Зерттеулер бұрын семіздікпен ауыратын науқастарда майлы тіндердің [43, 64], перифериялық қанның мононуклеарлы жасушаларының [77] және бұлшықет тіндерінің [78] ДНҚ-метилдену профильдері салмақ жоғалтқаннан кейін арық субъектілердің профильдеріне көбірек ұқсайтындығы туралы хабарлады. Салмақ жоғалту операциясы бауырдағы алкогольсіз майлы бауыр ауруымен байланысты метилдену өзгерістерін ішінара қалпына келтірді [79] және басқа зерттеуде семіздікке үміткер гендердің көп мөлшерінің гипометилденуіне әкелді, тері астындағы әсерлері оментальды (висцеральды) маймен салыстырғанда айқын болды [64] . Жинақталған дәлелдер жаттығулар интервенциясы ДНҚ метилденуіне де әсер етуі мүмкін екенін көрсетеді. Бұл зерттеулердің көпшілігі арық адамдарда жүргізілген [80 82], бірақ семіздік T2DM субъектілерінде бір жаттығу зерттеуі сонымен қатар ДНҚ метилденуіндегі өзгерістерді көрсетті, соның ішінде май қышқылы мен глюкозаның тасымалдануына қатысатын гендерде [83]. Эпигенетикалық өзгерістер қартаю кезінде де орын алады және соңғы мәліметтер семіздіктің оларды көбейтудегі рөлін көрсетеді [9, 84, 85]. Семіздік бауыр тінінің эпигенетикалық жасын тездетті, бірақ жоғарыда сипатталған мәліметтерден айырмашылығы, бұл салмақ жоғалғаннан кейін бұл әсер қайтымды болмады [84].
Босанғаннан кейінгі орта: Эпигеном эмбриональды даму кезеңінде де-ново түрінде орнатылады, сондықтан пренатальды орта эпигеномға айтарлықтай әсер етеді. Алайда, қазіргі кезде қартаю, токсиндердің әсерінен және диеталық өзгерістерден тұратын көптеген жағдайлардың әсерінен «жетілген» эпигеномда өзгерістер болатыны анық. Мысалы, қаңқа бұлшықетіндегі көптеген гендердегі ДНҚ метилденуінің өзгеруі және май тіндеріндегі PGC1A майлы тамақтануға жауап ретінде көрсетілген [75, 76]. Денедегі майдың массасын жоғалтуға арналған араласулар ДНҚ метилденуінің өзгеруімен де байланысты болды. Зерттеулер бұрын семіздікпен ауыратын науқастарда майлы тіндердің [43, 64], перифериялық қанның мононуклеарлы жасушаларының [77] және бұлшықет тіндерінің [78] ДНҚ-метилдену профильдері салмақ жоғалтқаннан кейін арық субъектілердің профильдеріне көбірек ұқсайтындығы туралы хабарлады. Салмақ жоғалту операциясы бауырдағы алкогольсіз майлы бауыр ауруымен байланысты метилдену өзгерістерін ішінара қалпына келтірді [79] және басқа зерттеуде семіздікке үміткер гендердің көп мөлшерінің гипометилденуіне әкелді, тері астындағы әсерлері оментальды (висцеральды) маймен салыстырғанда айқын болды [64] . Жинақталған дәлелдер жаттығулар интервенциясы ДНҚ метилденуіне де әсер етуі мүмкін екенін көрсетеді. Бұл зерттеулердің көпшілігі арық адамдарда жүргізілген [80 82], бірақ семіздік T2DM субъектілерінде бір жаттығу зерттеуі сонымен қатар ДНҚ метилденуіндегі өзгерістерді көрсетті, соның ішінде май қышқылы мен глюкозаның тасымалдануына қатысатын гендерде [83]. Эпигенетикалық өзгерістер қартаю кезінде де орын алады және соңғы мәліметтер семіздіктің оларды көбейтудегі рөлін көрсетеді [9, 84, 85]. Семіздік бауыр тінінің эпигенетикалық жасын тездетті, бірақ жоғарыда сипатталған мәліметтерден айырмашылығы, бұл салмақ жоғалғаннан кейін бұл әсер қайтымды болмады [84].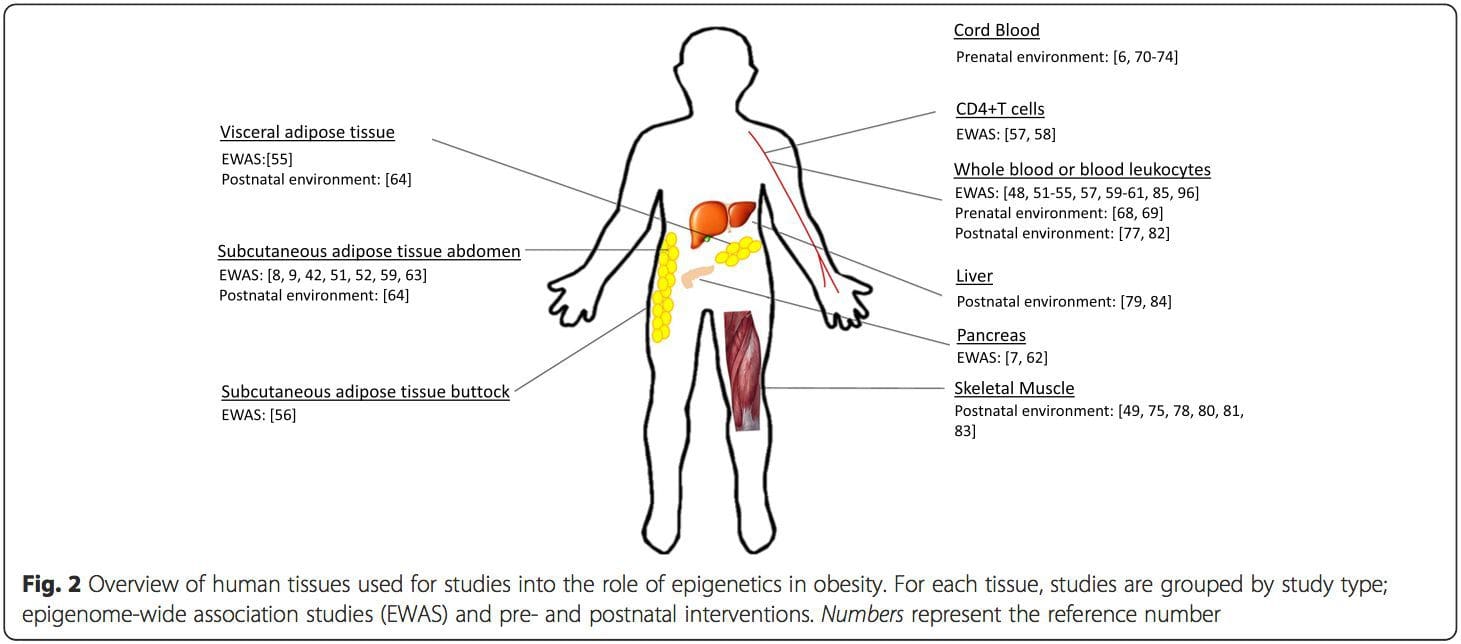 Қорытындылар
Қорытындылар



