Сульфорфан фитохимиялық зат, брокколи, қырыққабат, гүлді қырыққабат және Брюссель өскіндері сияқты крест тәрізді көкөністерде кездесетін күкірт органикалық қосылыстардың изоцианаттар тобына жататын зат. Оны сондай-ақ бок чай, қырыққабат, жаға, қыша жасылы және су крестінен табуға болады. Зерттеулер сульфорафанның қатерлі ісіктің әртүрлі түрлерінің алдын алуға көмектесетінін көрсетті Nrf2 өндірісін белсендіру, немесе ядролық фактор эритроид 2-байланысты фактор, жасушаның тотықтырғыштарға реакциясын бақылайтын қорғаныс антиоксиданттық механизмдерін реттейтін транскрипция факторы. Келесі мақаланың мақсаты сульфорафанның қызметін сипаттау болып табылады.
Мазмұны
дерексіз
KEAP1-Nrf2-ARE антиоксиданттық жүйесі жасушалардың тотығу және ксенобиотикалық стресстерге жауап беретін негізгі құралы болып табылады. Сульфорафан (SFN), крестгүлді көкөністерден алынған электрофильді изоцианат, KEAP1-Nrf2-ARE жолын белсендіреді және созылмалы тотығу стрессі негізгі этиологиялық рөл атқаратын ауруларды емдеуде қызығушылық тудыратын молекулаға айналды. Біз мұнда SFN-мен өңделген адамның торлы қабық пигментті эпителий (RPE-1) жасушаларының митохондриялары Nrf2 және оның KEAP1 цитоплазмалық тежегішіне тәуелсіз гиперфузияға ұшырайтынын көрсетеміз. Митохондриялық синтез апоптоз кезінде митохондрияларда кеуектер түзілуін тежеу арқылы цитопротекторлы екендігі туралы хабарланды және осыған сәйкес, біз Nrf2-тәуелсіз, апоптоз индукторы, стауроспорин әсеріне ұшыраған SFN өңделген жасушалардың цитопротекторын көрсетеміз. Механикалық түрде SFN Drp1 еритін бөліну факторының митохондрияға және пероксисомаларға тартылуын және/немесе сақталуын жеңілдетеді, бірақ жалпы Drp1 көптігіне әсер етпейді. Бұл деректер SFN пайдалы қасиеттері KEAP1-Nrf2-ARE жүйесін белсендірумен шектелмейтінін көрсетеді және осы агентті көптеген клиникалық сынақтарда ағымдағы пайдалануды ескере отырып, одан әрі сұрауға кепілдік береді.
Түйінді сөздер: Сульфорафан, Nrf2, Drp1, митохондрия, бөліну, синтез, апоптоз
кіріспе
Сульфорафан - митохондриялық бөлінудің Nrf2-тәуелсіз ингибиторы
Сульфорафан (SFN) – рационда көбінесе крестгүлді көкөністерден алынатын изотиоцианатты қосылыс [56]. Ол зақымдалған жасушалардан мирозиназа гидролитикалық ферментінің везикулярлы бөлінуі арқылы жыртқыштыққа ксенобиотикалық жауап ретінде өсімдіктерде түзіледі; бұл фермент глюкозинолаттарды изотиоцианттарға айналдырады [42]. Соңғы екі онжылдықта SFN қатерлі ісікке қарсы, антиоксиданттық және микробқа қарсы қасиеттері үшін кеңінен сипатталды [57]. Бұл тиімділіктің көп бөлігі SFN-ның KEAP1-Nrf2-антиоксиданттық жауап элементінің (ARE) сигнал беру жолын модуляциялау қабілетіне жатқызылған, дегенмен қосылыстың қосымша белсенділіктері анықталған, оның ішінде гистон деацетилаза белсенділігінің тежелуі және жасушалық циклдің прогрессиясы. 29]. Nrf2 негізгі антиоксиданттық транскрипция факторы болып табылады және гомеостаз жағдайында оның тұрақтылығы цитоплазмалық Cullin3KEAP1 убиквитин лигаза кешенінің әрекеті арқылы басылады [20]. Атап айтқанда, Nrf2 KEAP3 димерлі субстрат адаптерімен байланысу арқылы Cullin1KEAP1 лигазасына алынады және кейіннен протеазома арқылы деградацияға арналған транскрипция факторына бағытталған polyUb тізбектерімен модификацияланады. Бұл конститутивтік айналым кернеусіз жасушалардағы Nrf2 жартылай шығарылу кезеңін ~15 минутқа дейін шектейді [30], [33], [46], [55]. Стресстің көптеген түрлеріне, әсіресе тотығу стрессіне жауап ретінде, цистеинге бай ақуыз KEAP1 тотығу-тотықсыздану датчигі ретінде әрекет етеді және KEAP151 сыни цистеиндердің тотығу модификациясы, әсіресе C1, Nrf2-KEAP1-ді CUL3-тен ажыратады, осылайша Nrf2 деградациясының алдын алады. 8], [20], [55]. Атап айтқанда, SFN және, мүмкін, басқа Nrf2 активаторлары, KEAP151 C1 модификациясы арқылы тотығу стрессін имитациялайды, мысалы [21]. Nrf2 тұрақтандыруы оның ядроға ауысуына мүмкіндік береді, онда ол II фаза антиоксидантының және детоксикация гендерінің батареясының экспрессиясын тудырады. Nrf2 шағын Maf протеиндерімен гетеродимеризация арқылы өзінің туыстық мақсатты гендерінің антиоксиданттық реакция промотор элементтерімен (ARE) байланысады [19]. Бұл жүйе SFN сияқты жанама антиоксиданттарға, митохондриялар тудыратын бос радикалдарға [16] немесе тотығу стрессінің басқа физиологиялық көздеріне [41] динамикалық және сезімтал жауап береді.
Митохондриялар АТФ өндірісі мен жасушаішілік кальций буферлеуінен тотығу-тотықсыздану реттелуі мен апоптозға дейінгі көптеген жасушалық функцияларды реттейтін динамикалық, субклеткалы органеллалар болып табылады [13], [49]. Митохондриялар сонымен қатар жасуша ішіндегі реактивті оттегі түрлерінің (ROS) негізгі көзі болып табылады. Митохондриялық функцияны дұрыс реттеу жасушалық қажеттіліктерді қанағаттандыру үшін АТФ өндірісін оңтайландыру және бір мезгілде шамадан тыс бос радикалдар өндірісінің ықтимал зиянды әсерін азайту үшін қажет. Митохондриялық функцияның жұқа модуляциясының маңызды талабы митохондриялардың биохимиялық машиналар ретінде де, ауқымды, жауап беретін желінің бөлігі ретінде де тәуелсіз жұмыс істеу қабілеті болып табылады.
Митохондриялық желінің морфологиясы мен қызметі бөліну мен синтез арасындағы реттелетін тепе-теңдікпен анықталады. Митохондрияның бөлінуі жасушаның бөлінуі [28] кезіндегі митохондриялардың еншілес жасушаларының тұқым қуалауы үшін, сондай-ақ митофагия деп аталатын деполяризацияланған немесе зақымдалған митохондриялардың селективті, автофагиялық деградациясы үшін қажет [1]. Керісінше, синтез митохондриялық геномдарды толықтыру және көрші митохондриялар арасында электронды тасымалдау тізбегі компоненттерін бөлісу үшін қажет [54]. Молекулалық деңгейде митохондрияның бөлінуі және синтезі үлкен динамин тәрізді ГТФазалармен реттеледі. Үш фермент негізінен синтезді реттейді: Митофусиндер 1 және 2 (Mfn1/2) көрші митохондриялар арасындағы гетеротиптік өзара әрекеттесу арқылы сыртқы мембрана синтезіне делдал болатын екі жолды сыртқы мембраналық ақуыздар [15], [25], [37], ал OPA1 - ішкі ішкі мембраналардың балқуын реттей отырып, бір мезгілде матрицаның қосылуын қамтамасыз ететін мембраналық ақуыз [5]. Барлық үш ақуыздың GTPase белсенділігі сенімді синтез үшін қажет [5], [18] және OPA1 одан әрі OMA1 [14], PARL [6] және YME1L [45] протеазалары арқылы митохондриялық ішкі мембранадағы күрделі протеолиз арқылы реттеледі. ]. Маңыздысы, зақымдалған және сау митохондриялардың интеграциясын басу үшін тиімді біріктіру үшін бұзылмаған митохондриялық мембрана потенциалы қажет [26].
Митохондрияның бөлінуі негізінен динаминмен байланысты ақуыз 1 (Drp1/DNM1L) деп аталатын цитозолдық ақуыз арқылы катализденеді. Drp1 цитозолдан митохондриялық сыртқы мембранадағы болашақ бөліну орындарына тартылады [43]. Сыртқы мембранадағы Drp1 үшін негізгі рецепторлар митохондриялық бөліну факторы (Mff) [32] және азырақ дәрежеде бөліну 1 (Fis1) [51] болып табылады. Сонымен қатар, потенциалды бөліну орындарында Drp1 протеинінің белсенділігін одан әрі шектейтін MIEF51/MiD1 деп аталатын алдамшы рецептор табылды [58]. Митохондрияның сыртқы мембранасына бекітілгеннен кейін Drp1 митохондрия денесінің айналасында спираль тәрізді құрылымдарға айналады, содан кейін митохондрияның сыртқы және ішкі мембраналарының физикалық ыдырауына делдал болу үшін GTP гидролизінен алынған энергияны пайдаланады [17]. Эндоплазмалық ретикулумнан алынған түтікшелер Drp1 олигомеризациясына дейін митохондриялардың бастапқы констрикторы ретінде әрекет етеді, бұл тарылмайтын митохондриялар аяқталған Drp1 спиральының рұқсат етілген шеңберінен кеңірек екенін көрсетеді [12]. Актин динамикасы митохондриялық бөлінуден бұрын болатын ER-митохондрия әрекеттесуі үшін де маңызды [24]. Митохондриялық бөлінудегі рөлінен басқа, Drp1 пероксисомалардың бөлінуін катализдейді [40].
Drp1 жақсы сипатталған динамин протеиніне өте ұқсас, өйткені екі протеинде де N-терминалды GTPase домені, өзін-өзі олигомеризация үшін маңызды ортаңғы домен және C-терминал GTPase эффекторлық домені бар [31]. Drp1 өзінің рецепторлық ақуыздары Mff және Fis1 өзара әрекеттесу арқылы, сондай-ақ Drp1 бірегей B-кірістіру домені арқылы митохондрияға тән фосфолипидті кардиолипинге жақындығы арқылы митохондриялық мембраналар үшін селективтілікке қол жеткізеді [2]. Drp1 әдетте цитоплазмада гомотетрамер ретінде болады және митохондриялық бөліну орындарында жоғары ретті жинақ Drp1 ортаңғы домені арқылы жүзеге асады [3].
Митохондриялық функция мен KEAP1-Nrf2-ARE жолы арасындағы жасырын байланысты ескере отырып, біз Nrf2 белсендіруінің митохондриялық құрылым мен функцияға әсерін зерттедік. Біз бұл жерде SFN күтпеген жерден Nrf2 және KEAP1 екеуіне де тәуелсіз митохондриялық гиперфузияны индукциялайтынын көрсетеміз. SFN бұл әсері Drp1 функциясын тежеу арқылы жүзеге асады. Әрі қарай біз SFN Nrf2-ге тәуелсіз апоптозға төзімділік беретінін және Drp1 азайған жасушаларда байқалғанды қайталайтынын көрсетеміз. Бұл деректер жалпы Nrf2 тұрақтандыру және белсендіруден басқа, SFN митохондриялық динамикасын модуляциялайтынын және жасушалық фитнес пен өмір сүруді сақтайтынын көрсетеді.
нәтижелері
Сульфорафан Nrf2/KEAP1-митохондриялардың тәуелсіз гиперфузиясын тудырады
Nrf2 активациясының митохондриялық желі динамикасына әсерін зерттеу барысында біз өлмейтін, адамның ретинальды пигментті эпителий (RPE-1) жасушаларын сульфорафанмен (SFN), Nrf2 сигнализациясының күшті активаторымен өңдеудің берік синтезін тудырғанын анықтадық. көлікпен өңделген бақылау жасушаларымен салыстырғанда митохондриялық желі (сурет 1А және В). Бұл жасушалардағы митохондриялардың морфологиясы негізгі митохондриялық бөліну факторы болып табылатын эндогендік Drp1 siRNA-сы арқылы таусылған жасушалардағы митохондрияларға қатты ұқсайды (1А-сурет). Бұл нәтиже митохондриялық бөліну және синтез күйі жасушадағы Nrf2 деңгейлеріне тікелей жауап беретін қызықты идеяны көтерді. Дегенмен, жасушаларды басқа Nrf2 тұрақтандырғыштарымен және активаторларымен, мысалы, MG132 протеазома тежегішімен, прооксидантты tBHQ немесе Nrf2 ингибиторы KEAP1 нокдаунымен ынталандыру митохондриялық синтезді индукциялаған жоқ (1А және В-сурет). Осы манипуляциялар арқылы Nrf2 тұрақтандыруы эндогендік Nrf2 үшін вестерн блотинг арқылы расталды (1С-сурет). Сонымен қатар, Nrf2 экспрессиясы SFN-индукцияланған митохондриялық синтез үшін қажет болды, өйткені siRNA-мен эндогендік Nrf2 нокдаун бұл фенотипке қарсы тұра алмады (1D�F-сурет). SFN KEAP1 [2] цистеин қалдықтарын ковалентті түрлендіру арқылы KEAP1-Nrf21-ARE жолын ынталандыратындықтан, біз SFN-индукциялаған митохондриялық гиперфузияның KEAP1-тәуелді, бірақ Nrf1 тәуелсіз жолы арқылы ынталандырылғанын анықтау үшін KEAP2-ді бұздық. Дегенмен, KEAP1 азаюы SFN-индукцияланған митохондриялық синтезді де жоққа шығара алмады (1G�I-сурет). Іс жүзінде, SFN KEAP1 сарқылуынан туындаған про-бөліну морфологиясын өзгертті (сурет 1G, b панелі d панеліне қарсы). Бұл нәтижелер SFN емдеу канондық KEAP1-Nrf2-ARE жолына тәуелсіз митохондриялық синтезді тудыратынын көрсетеді және SFN митохондриялық бөліну немесе термоядролық механизмнің құрамдастарына тікелей әсер ететінін сұрауға әкелді.
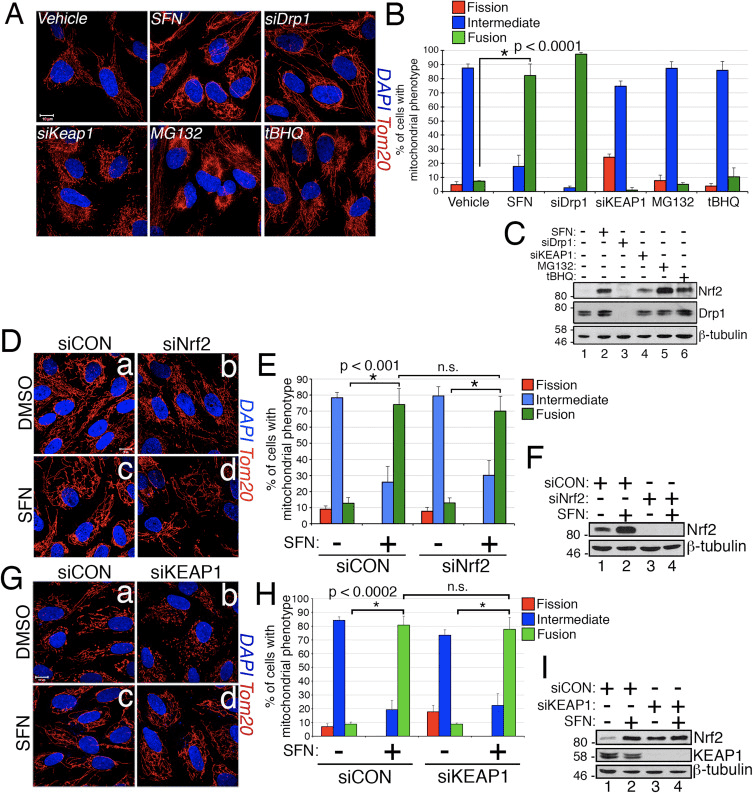
Сульфорафан Drp1 митохондриялық ассоциациясын бұзады
SFN-емдеу митохондриялық гиперфузияны индукциялайды деген тұжырымға сүйене отырып, біз бұл фенотип не шамадан тыс синтез белсенділігінің салдары немесе бөліну белсенділігінің тежелуінің салдары деп ойладық. Осы екі мүмкіндікті ажырату үшін біз SFN бар және жоқ пероксисомалардың морфологиясын салыстырдық. Пероксисомалар митохондрияларға ұқсас, олар пішіні мен ұзындығы үнемі ағында болатын динамикалық органеллалар [44]. Пероксисомалар сыртқы қабықшасында Fis1 де, Mff да бар және соның салдарынан Drp1 арқылы бөлінудің нысанасы болып табылады [22], [23]. Дегенмен, пероксисомалар митохондриялық желінің біріктіру механизмін пайдаланбайды, демек, синтезге ұшырамайды [39]. Керісінше, пероксисомалық бөлінуге мембраналар мен ақуыздарды жаңадан қосу арқылы бар пероксисомалардың ұзаруы қарсы тұрады [44]. Пероксисомаларда Mfn1/2 және OPA1 жоқ болғандықтан, егер SFN бөліну механизмін тежеуден гөрі термоядролық аппаратты белсендірсе, пероксисома ұзындығына әсер етпейтінін түсіндік. Көлікпен өңделген жасушаларда пероксисомалар қысқа, дөңгелек, нүкте тәрізді органеллалар түрінде сақталады (2-сурет, b және d панельдері). Дегенмен, SFN өңдеу бақылау жасушаларымен салыстырғанда пероксисома ұзындығын ~ 2 есе арттырды (Cурет 2, панельдер f және h). Сонымен қатар, пероксисомалардың көпшілігі орталыққа жақын жерде қысылып қалды, бұл ықтимал үзу ақауын көрсетеді (Cурет 2, h панелі, көрсеткі ұштары). Сол сияқты Drp1 siRNA арқылы трансфекцияланған жасушалардағы пероксисомалар әдеттен тыс ұзын болды (2-сурет, j және l панельдері), бұл Drp1 пероксисомалық бөліну үшін қажет екенін растайды және SFN-емдеу бөліну механизмін бұзу арқылы митохондриялық және пероксисомалық фенотиптерді тудырады деп болжайды.
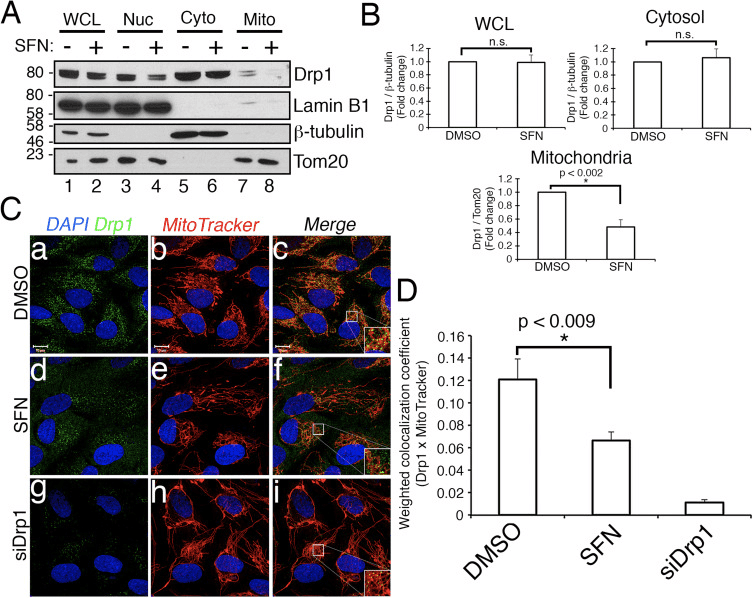
Әрі қарай SFN Drp1 функциясын қалай шектейтінін анықтадық. Мүмкіндіктер экспрессия деңгейлерінің төмендеуін, митохондриядағы жинақтауды/ұстауды, олигомеризацияны немесе GTPase ферменттік белсенділігін қамтиды. Олардың кез келгенінің жетіспеушілігі митохондриялық бөлінудің және гиперфузияның төмендеуіне әкеледі. Біз SFN-өңдеуден кейін Drp1 ақуызының деңгейінде қайталанатын өзгерістерді анықтамадық (1С және 3А-суреттер), сондықтан SFN Drp1 тұрақтылығын немесе экспрессиясын өзгертпейді деген қорытындыға келдік, Drp1 жартылай шығарылу кезеңі >10 сағ [50] және біздің SFN емдеу ұзақтығы қысқарақ. Содан кейін біз SFN Drp1-нің митохондрияға тартылуына немесе сақталуына әсер еткенін зерттедік. Фракциялау зерттеулері SFN митохондриялық фракциядан Drp1 жоғалтуын тудырғанын көрсетті (3A-сурет, 7-8 жолақтар және 3В-сурет). Бұрын хабарланғандай [43], Drp1 аз ғана бөлігі (~3%) ферменттің көп бөлігі цитоплазмада болатын тұрақты күй жағдайында кез келген уақытта митохондриялық желімен байланысты (Cурет 3A, 5�8 жолақтары). ). Бұл фракциялау деректері SFN-өңдеуден кейін митохондрия-локализацияланған, нүктелік Drp40 ошақтарының ~1%-ға төмендеуін көрсететін ко-локализация талдауы арқылы расталды (3C және D-сурет). Бірге бұл деректер SFN индукциялаған митохондриялық синтез, кем дегенде ішінара Drp1-нің митохондриямен әлсіреген байланысына байланысты екенін көрсетеді. Біздің деректеріміз SFN-ның Drp1-нің митохондриялық ұсталуына қарсы митохондриялық рекрутингке кедергі келтіретінін немесе екеуін де ажыратпайды, өйткені эндогендік Drp1 талдауы GTPase-ны тірі жасуша микроскопиясы арқылы визуализациялау мүмкін болмады.
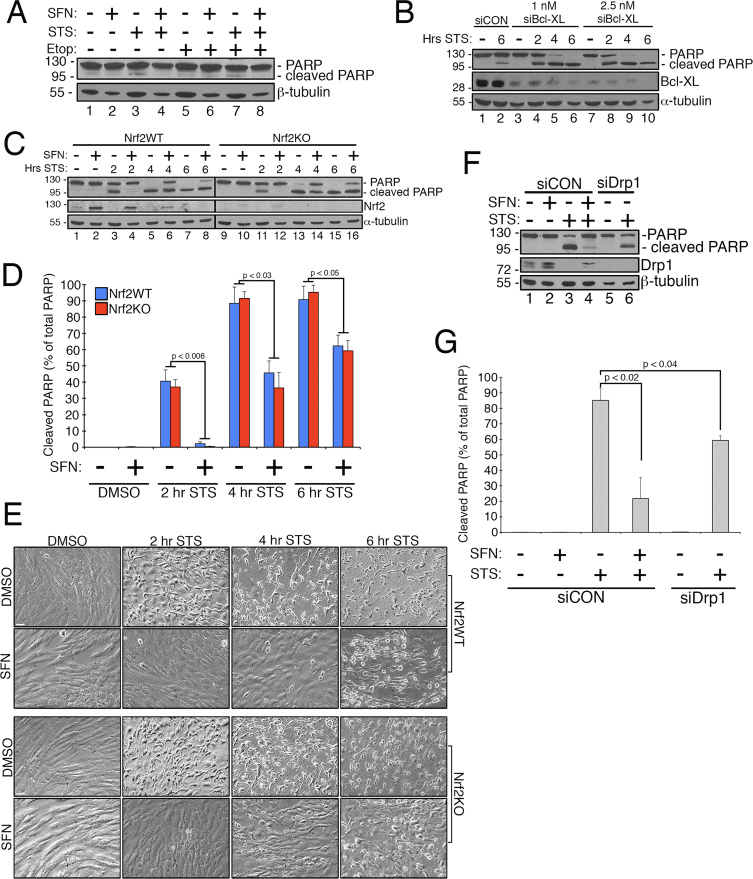
Сульфорафан Nrf2-ге тәуелсіз староспортин тудыратын апоптоздан қорғауды қамтамасыз етеді
Алдыңғы жұмыс митохондриялық ыдырау апоптоз кезінде Bax/Bak тудыратын сыртқы митохондриялық мембранадағы кеуектердің пайда болуына рұқсат беретінін көрсетті [11]. Drp1 апоптоз [11] кезінде митохондрияларға таңдамалы түрде тартылатыны көрсетілді [27] және осыған сәйкес, процестің басында фрагменттелген митохондриялар байқалды [53]. Керісінше, митохондриялық ыдырауды тежеу цитохром с шығарылуына мүмкіндік беретін сыртқы мембрана кеуектерінің түзілуін блоктау арқылы апоптозды тежейді деп саналады [14]. Тиісінше, митохондриялық синтезді ынталандыру стауроспоринді (STS) қоса алғанда, қосылыстардан туындаған апоптоздың үдеуін кешіктіреді [1]. SFN RPE-2 жасушаларын STS арқылы апоптоздан қорғайтынын анықтау үшін, егер солай болса, бұл үшін Nrf3 қажет пе, біз белсендірілген каспаза-1 субстраты және айқын маркері болып табылатын полиАДФ рибоза полимеразасының (PARP) бөлінуін оңай индукциялау үшін талдау жасадық. апоптоз. RPE-1 жасушаларын 6 μM STS-пен 4 сағат бойы өңдеу PARP-ның өте қарапайым бөлінуін тудырды, бірақ бұл SFN бірге өңдеуі арқылы алдын алды (мысалы, 3А-сурет, 4-жолақ 4-ке қарсы). Осы талдаудың сенімділігін арттыру үшін біз жасушаларды апоптозға қарсы фактор, Bcl-XL бағытталған siRNA-мен алдын ала өңдеу арқылы STS-индукцияланған апоптозға сезімталдықты арттырдық. Бұл алдын ала өңдеу Bcl-XL экспрессиясын азайтты және STS әсеріне ұшыраған уақыт функциясы ретінде PARP бөлінуін айтарлықтай жақсартты (Cурет 2В, 4-жолды 10�2 жолақтарымен салыстырыңыз). Маңыздысы, SFN-мен 4 сағат алдын ала өңдеу STS әсеріне ұшыраған жасушаларда PARP бөлінуін жеңілдетеді (Cурет 3C, 4-жолақ 5-ке қарсы және 6-жолақ 2-ға қарсы). Сол сияқты, CRISPR/Cas9 арқылы Nrf4 тұрақты түрде азайған жасушалар SFN алдын ала өңдеу арқылы STS уыттылығынан салыстырмалы түрде қорғалған (Cурет 11C, 12 жолақ 13-ге қарсы және 14-жолақ 4-ке қарсы және 4D-сурет). Бұл қорғаныс PARP бөлінуін (4C және D-сурет) және ұялы морфологияны (2E-сурет) көрсеткіштер ретінде пайдалану арқылы байқалды. CRISPR/Cas9 арқылы Nrf4 сарқылуының тиімділігі western blotting арқылы расталды (Cурет 2C, Nrf1 blot). Болжамдалғандай, Drp1-нің таусылатын жасушалары, сонымен қатар гиперфузиялық фенотипті береді (4А-сурет), SFN-мен инкубацияланған бақылау жасушаларымен салыстырғанда, STS-ке жауап ретінде PARP бөлінуін тежейді (сурет 1F және G). Бірге бұл нәтижелер Nrf2 тұрақтандыруы мен белсендіруіне тәуелсіз DrpXNUMX функциясын шектеу қабілеті арқылы апоптоздан қорғауды қамтамасыз ететін SFN-ге сәйкес келеді.
талқылау
Біз SFN KEAP1-Nrf2-ARE жолына әсерінен тәуелсіз митохондриялық бөліну/біріктіру динамикасын модуляциялайтынын анықтадық. Бұл митохондриялық дисфункция мен ROS өндірісі арасындағы болжамды байланысқа және Nrf2 белсендіру арқылы митохондриядан алынған бос радикалдарды басу қажеттілігіне байланысты қызықты. SFN-ның бұл қосымша функционалдық әсері қазіргі уақытта әртүрлі ауруларды, соның ішінде простата обырын, өкпенің обструктивті ауруын және орақ жасушалы ауруларын емдеу үшін SFN сыналатын 30-дан астам клиникалық сынақтарды ескере отырып, әлеуетті маңызды болып табылады [7], [10], [ 47].
SFN изотиоцианат [56] болғандықтан және ол Nrf2 деградациясын басу [1] үшін критикалық KEAP2 цистеиндерін тікелей ациляциялау арқылы Nrf21 сигналын белсендіретіндіктен, SFN цистеинді модификациялау арқылы бөліну немесе синтез факторының белсенділігін модуляциялау арқылы өзінің синтездік әсерлерін көрсетеді. . Біздің деректер Drp1-нің SFN арқылы теріс реттелуін қатты қолдайды, дегенмен GTPase ацилденудің тікелей нысанасы болып табыла ма, жоқ па, әлі анықталуы керек. Осы білім алшақтығына қарамастан, Drp1 функциясы SFN арқылы анық бұзылады, өйткені митохондриялар да, пероксисомалар да SFN емдеуге жауап ретінде гиперфлизияға ұшырайды және бұл органеллалар Drp1-ді сәйкес кесу оқиғалары үшін бөліседі [38]. Сонымен қатар, SFN митохондрияларда локализацияланатын және жинақталатын Drp1 мөлшерін азайтады (Cурет XNUMX). 3). Біздің эксперименттер барлық эндогендік ақуыздармен жасалғандықтан, митохондриялық бөліну орындарында Drp1 анықтауымыз тұрақты күйде болады, демек, SFN тудыратын ферменттің рекрутинг пен ұстап қалу ақауын ажырата алмаймыз. Әрі қарай, SFN митохондриядағы (Fis1 немесе Mff) рецепторды ацилдендіретін Drp1 рекрутингін блоктау мүмкіндігін әлі жоя алмаймыз, біз Drp1 тікелей өзгертілген деп күдіктенеміз. Drp1-де тоғыз цистеин бар, олардың сегізі олигомеризацияға қажет [3] ортаңғы доменде орналасқан және олардың біреуі Drp1-нің C-терминусында GTPase эффекторлық доменінде (GED) орналасқан. Осы цистеиндердің кез келгенінің тікелей ацилденуі Drp1-де белсенділік ақауын тудыруы мүмкін және сондықтан митохондриялық динамикаға SFN әсерінің негізінде жатыр. Атап айтқанда, алдыңғы жұмыс олигомеризация мен каталитикалық белсенділіктің ақаулары митохондриядағы Drp1 сақталуын болдырмайды [52]. GED доменіндегі Cys644 - бұл цистеиннің мутациясының Drp1 GTPase белсенділігін [4] нашарлататын мутацияларды [9] және осы нақты цистеинді тиол-реактивті электрофилдер [XNUMX] өзгертетінін көрсететін алдыңғы жұмысқа негізделген ерекше тартымды мақсат. Бұл маңызды сұрақтың шешімі масс-спектрометриялық валидацияны қажет етеді. Қорытындылай келе, біз клиникалық тұрғыдан маңызды қосылыс SFN үшін жаңа, цитопротекторлық функцияны анықтадық. Nrf2 негізгі антиоксиданттық транскрипция факторын белсендіруден басқа, SFN митохондриялық және пероксисомалық синтезді ынталандырады және бұл әсер Nrf2-ге тәуелсіз. Бұл құбылыстың негізінде жатқан механизм митохондриялық және пероксисомалық бөлінудің негізгі медиаторы GTPase Drp1 функциясының төмендеуін қамтиды. SFN-делдалдық митохондриялық синтездің негізгі салдары жасушалардың апоптоз индукторы стауроспориннің уытты әсеріне төзімді болуы болып табылады. SFN-ның бұл қосымша цитопротекторлық әсері жасы жетекші қауіп факторы болып табылатын көптеген нейродегенеративті ауруларда (мысалы, Паркинсон ауруы, Альцгеймер ауруы, жасқа байланысты макулярлы дегенерация) ерекше клиникалық пайдалы болуы мүмкін, өйткені бұл аурулар апоптозбен байланысты және төмендеген. деңгейлері және/немесе Nrf2 реттелуінің бұзылуы [35], [36], [48].
Материалдар мен әдістер
Апоптозды талдау
Жасушалар егілді және төменде көрсетілгендей siRNA-мен трансфекцияланды. Жасушалар митохондриялық синтезді индукциялау үшін 50 сағат бойы 2 ?М сульфорафанмен алдын ала өңделді, содан кейін апоптозды индукциялау үшін 1 ?М староспоринмен өңделді. Егін жинау кезінде орталар жеке түтіктерге жиналды және түйіршіктердің апоптотикалық жасушаларына жоғары жылдамдықпен центрифугалауға ұшырады. Бұл жасуша түйіршіктері жабысатын жасушалармен біріктіріліп, 2 есе концентрленген Лаэммли буферінде ерітілді. Үлгілер анти-PARP western blottingке ұшырады.
CRISPR/Cas9 Construct Generation
LentiCRISPR/eCas9 1.1 жасау үшін LentiCRISPR v2 (қосымша №52961) алдымен Age1 және BamH1 көмегімен кесілген. Одан кейін eSpCas9 9 (addgene №1.1) SpCas71814 келесі праймерлерді (алға AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, кері AAGCGCGGATTCCCCGTTGT векторына кесілген және жоғарыда кесілген) пайдалана отырып, Age1 және BamH1 асып түсуімен ПТР күшейтілді. sgRNA реттілігі Benchling.com арқылы анықталды. Параметрлер ең жоғары мақсатты және ең төменгі мақсаттан тыс ұпайлары бар кодтау тізбегін бағыттау үшін орнатылды. мынадай реттілігі (ретін бағытталған, HS sgNFE2L2 # 1 сезімі CACCGCGACGGAAAGAGTATGAGC, антисмысловой AAACGCTCATACTCTTTCCGTCGC атап; HS sgNFE2L2 # 2 сезімі CACCGGTTTCTGACTGGATGTGCT, антисмысловой AAACAGCACATCCAGTCAGAAACC; HS sgNFE2L2 # 3 сезімі CACCGGAGTAGTTGGCAGATCCAC, антисмысловой AAACGTGGATCTGCCAACTACTCC) BsmB1 ішіне жасыту және лигируют болды LentiCRISPR / eCas9 1.1 кесіп. Лентивирусты жұқтырған RPE-1 жасушалары пуромицинмен таңдалды және біріктірілген популяция ретінде сақталды. Нокаут иммунофлуоресценция және вестерн-блотинг арқылы расталды.
Жасуша мәдениеті және трансфекциялар
Теломераза (RPE-1) (ATCC) көмегімен трансформацияланған адамның ретинальды пигментті эпителий жасушалары пенициллинмен, стрептомицинмен, 1X маңызды емес амин қышқылы коктейльімен (Life Technologies) толықтырылған 1 г/л глюкоза бар Dulbecco's Modified Eagle Medium (DMEM) ішінде өсірілді. және 10% ұрықтың сиыр сарысуы (Life Technologies). siRNA-трансфекциялары үшін түнде 30,000 35,000-10 0.3 жасуша/мл себілді. Жасушалар сарысусыз DMEM-де сұйылтылған және 1% интерферин трансфекциялық реагентімен (PolyPlus) біріктірілген 2 нМ siRNA алды. Апоптозды сенсибилизациялау үшін жасушалар 3 нМ Bcl-XL siRNA алды. Жасушалар трансфекциядан кейін XNUMX-XNUMX күннен кейін жиналды.
Химиялық заттар, антиденелер және siRNA олигосы
?-тубулинге (Жасуша сигнализациясы), ?-тубулинге (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) және Tom20 (BD Biosciences) қарсы антиденелер ) western blotting және иммунофлуоресценция үшін 1:1000 сұйылтуда қолданылды. Үйде анти-Nrf2 қоян антиденесі 1:2000-де вестерн блотинг үшін қолданылды [34], [59]. Сульфорафан (Сигма) және стауроспорин (Токрис) сәйкесінше 50 ?М және 1 ?М пайдаланылды. Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (Жасуша сигнализациясы) және Bcl-XL (Жасуша сигнализациясы) қарсы siRNAs 10 нМ, егер басқаша көрсетілмесе.
Иммунофлуоресценция және in Vivo таңбалауы
18 мм шыны жабындарға себілген жасушалар көлікпен немесе препаратпен өңделді, 3.7% формальдегидте бекітілді, содан кейін 0.2% Triton X-100/PBS ішінде 10 минут бойы мұзда өткізгіштікке ұшырады. Бастапқы антиденелер түнде 3 °C температурада PBS ішінде 4% сиыр сарысуы альбуминінде (BSA) инкубацияланды. PBS жуудан кейін жасушалар 1% BSA/PBS ішінде түрге сәйкес, Alexa488- немесе Alexa546-, конъюгацияланған қайталама антиденелерде (1:1000 сұйылтылған) және 0.1 ?г/мл DAPI (Sigma) ішінде 3 сағат бойы инкубацияланды. Митохондриялар анти-Tom20 иммунофлуоресценция арқылы немесе фиксация алдында 200 минут бойы 30 °C температурада сарысусыз DMEM-де 37 нМ MitoTracker Red CMXRos (Molecular Probes, Inc.) инкубациялау жасушалары арқылы көрінді.
Микроскопия және кескінді талдау
Иммунофлуоресценция үлгілері LSM710 Конфокальды микроскопта (Карл Цейс) қаралды. Микросуреттер 63X немесе 100X майға батыру мақсаттары мен Adobe Photoshop CS6 көмегімен реттеліп, жақсартылған кескіндер арқылы түсірілді. Бірлескен локализация талдауы үлгілердің идентификациясына көз жұмған кезде қолмен орнатылған шекті мәндері бар Carl Zeiss LSM710 бірлескен локализация мүмкіндігі арқылы орындалды. Масштаб жолақтары, егер басқаша көрсетілмесе, 10 μм құрайды. Митохондриялық морфология соқыр баллмен бағаланды. Егер жасушаның митохондриялары көп, дөңгелек, дискриминацияланған нүктелер ретінде сақталса, жасуша «бөліну» деп бағаланды. Егер жеке митохондриялар бір-бірінен ажыратылмайтын болса және бүкіл митохондриялық желі үздіксіз болып көрінсе, жасуша «фузия» деп бағаланды. Барлық басқа жасушалар, соның ішінде кластерленген митохондриялары бар жасушалар «аралық» ретінде бағаланды.
Субклеткалық фракциялар
RPE-1 жасушалары түйісетін жерге дейін өсірілді. PBS жуудан кейін жасушалар 600 минут бойы 10 μг температурада центрифугалауға ұшырады және 600 ?L оқшаулау буферінде (210 мМ маннитол, 70 мМ сахароза, 5 мм MOPS, 1 мМ ПМ ЭДТА рН 7.4+1мм) қайта суспензияланды. Суспензия Dounce гомогенизаторында 30 рет лизистелген. Гомогенаттың бір бөлігі «тұтас жасуша лизаты» ретінде сақталды. Қалған бөлігі түйіршіктердің ядроларына айналу үшін 800 минут бойы 10°г температурада центрифугалауға ұшырады. Қалған ядроларды және лизиске ұшырамаған жасушаларды тазарту үшін супернатанттар 1500 минут бойы 10 г центрифугалауға ұшырады. Бұл үстіңгі зат митохондрияларды түйіршіктеу үшін 15,000 15 г температурада XNUMX минут бойы центрифугалауға ұшырады. Супернатант «цитозолдық фракция» ретінде сақталды. Түйіршік PBS-пен ақырын жуылды және оқшаулау буферінде қайта суспензияланды. Әрбір фракцияның ақуыз концентрациясы бицинхонин қышқылы (BCA) талдауымен өлшенді және ақуыздың баламалы мөлшері SDS-PAGE арқылы шешілді.
Western Blotting
Жасушалар PBS-те жуылды және 2 рет концентрленген Laemmli еріткіш буферде (100 мМ Tris [pH 6.8], 2% SDS, 0.008% бромофенол көк, 2% 2-меркаптоэтанол, 26.3% глицерин және P.0.001) ерітілді. Лизаттар натрий додецил сульфаты (SDS) полиакриламидті гельдерге тиеу алдында 5 минут қайнатылды. Ақуыздар нитроцеллюлоза мембраналарына ауыстырылды және мембраналар 1% сүт/TBST ішінде 5 сағат бойы блокталды. Бастапқы антиденелер 5% Сүт/TBST сұйылтылған және 4 °C температурада түні бойы дақпен инкубацияланған. Желкек пероксидазасы (HRP)-конъюгацияланған қайталама антиденелер 5% сүт/TBST сұйылтылған. Блоттар жақсартылған хемилюминесценциямен өңделді және ImageJ бағдарламалық құралының көмегімен денситометриялық көрсеткіштер орындалды.

Сульфорафан - брокколиді, қырыққабатты, түсті қырыққабатты, қырыққабатты, қырыққабатты және басқаларды қоса алғанда, крест тәрізді көкөністерден алынған күкірт органикалық заттардың изотиоцианаттар коллекциясынан алынған химиялық зат. Сульфорафан мирозиназа ферменті глюкозинолат болып табылатын глюкорафанинді сульфорафан-глюкозинолат деп те аталатын сульфорафанға айналдырғанда түзіледі. Брокколи өскіндерінде және гүлді қырыққабатта глюкорафаниннің немесе сульфорафанның прекурсорының ең жоғары концентрациясы бар. Зерттеулер көрсеткендей, сульфорафан әртүрлі денсаулық мәселелерінің алдын алу үшін адам ағзасының антиоксиданттық мүмкіндіктерін арттырады. Доктор Алекс Хименес DC, CCST Insight
Сульфорафан және оның қатерлі ісікке, өлімге, қартаюға, ми мен мінез-құлыққа, жүрек ауруына және басқаларына әсері
Изотиоцианаттар сіздің диетаңызға түсетін ең маңызды өсімдік қосылыстарының бірі болып табылады. Бұл бейнеде мен олар үшін жасаған ең жан-жақты жағдайды жасаймын. Қысқаша назар аударыңыз ба? Төмендегі уақыт нүктелерінің бірін таңдап, сүйікті тақырыпқа өтіңіз. Толық уақыт шкаласы.
Негізгі бөлімдер:
- 00: 01: 14 - қатерлі ісік және өлім
- 00: 19: 04 - қартаю
- 00: 26: 30 - Ми және мінез
- 00: 38: 06 - Соңғы қорытынды
- 00: 40: 27 - Доза
Толық уақыт шкаласы:
- 00: 00: 34 - бейнефильмнің басты тақырыбы - сульффоран енгізу.
- 00: 01: 14 - Өсімдік тұтыну және барлық өлім-жітімде қысқарту.
- 00: 02: 12 - простата қатерлі ісігі.
- 00: 02: 23 - Мочевина рагы қатер.
- 00: 02: 34 - темекі шегудегі қатерлі ісік.
- 00: 02: 48 - Сүт безі қатерлігі қатері.
- 00: 03: 13 - Гипотетикалық: егер сізде рак бар болса? (интервенционалдық)
- 00: 03: 35 - қатерлі ісік пен өлім қауымдасқан деректерді басқаратын шынайы механизм.
- 00: 04: 38 - сульфорфан және қатерлі ісік.
- 00: 05: 32 - егеуқұйрықтардағы ісік ісігін дамытуға арналған брокколи өсімдік сығындысының күшті әсерін көрсететін жануарлы дәлел.
- 00: 06: 06 - Протеин қатерлі ісігіндегі науқастарда сульффоран тікелей қосылыстың әсері.
- 00: 07: 09 - Кеудеге арналған матадағы изотиоцианат метаболиттерінің биоаккумуляциясы.
- 00: 08: 32 - Сүт безі қатерлі ісігінің жасушаларын ингибирлеу.
- 00: 08: 53 - Тарих сабағы: brassicas ежелгі Римде де денсаулық қасиеттеріне ие болған.
- 00: 09: 16 - Сульфорфанның канцерогенді кетіруді жақсарту қабілеті (бензол, акролеин).
- 00: 09: 51 - NRF2 антиоксидантты жауап элементтері арқылы генетикалық қосқыш ретінде.
- 00: 10: 10 - NRF2 активтеуі глутатион-S-конъюгаттары арқылы канцерогенді кетіруді жақсартады.
- 00: 10: 34 - Брюссель өскіндері глутатион-S-трансферазаны көбейтеді және ДНҚ-ның зақымдануын азайтады.
- 00: 11: 20 - Брокколи сығындысы 61% арқылы бензолдың экскрециясын арттырады.
- 00: 13: 31 - Брокколидің гомогенаты жоғарғы тыныс жолындағы антиоксидантты ферменттерді арттырады.
- 00: 15: 45 - Өсімдік тұтыну және жүрек ауруының өлімі.
- 00: 16: 55 - Брокколи өсімдік ұнтағы қан липидтерін және 2 типті қант диабетімен ауыратын жалпы жүрек ауруын жақсартады.
- 00: 19: 04 - қартаюдың басталу бөлімі.
- 00: 19: 21 - Сулфорапанмен байытылған диета 15-дан 30% -ке дейін (белгілі бір жағдайларда) қоңыздардың өмір сүру мерзімін арттырады.
- 00: 20: 34 - ұзаққа созылған қабынудың маңыздылығы.
- 00: 22: 05 - Cruciferous көкөністер мен брокколи ұнтағы ұнтақ адамдарда қабыну белгілерінің кең спектрін төмендетеді.
- 00: 23: 40 - Орташа бейне жазбалары: қатерлі ісік, қартаю бөлімдері
- 00: 24: 14 - Тінтуірдің зерттеуі sulforaphane кәрілік кезінде адаптивті иммундық функцияны жақсартуға мүмкіндік береді.
- 00: 25: 18 - Sulforaphane шашты тышқанның тінтуір моделінде шаш өсуін жақсартады. 00 ішіндегі сурет: 26: 10.
- 00: 26: 30 - мидың және мінез-құлық бөлімінің басы.
- 00: 27: 18 - аутизмге арналған брокколи өсімдік сығындысының әсері.
- 00: 27: 48 - глюкурофенияларға арналған глюкурофанның әсері.
- 00: 28: 17 - Депрессияның талқылануын бастау (ықтимал механизм мен зерттеулер).
- 00: 31: 21 - Стресс-индуцирленген депрессияның 10 түрлі модельдерін қолданып тышқандарды зерттеу, сульфарфетан сияқты флоксин (prozac) сияқты тиімді.
- 00: 32: 00 - зерттеу тышқандарда глюкарофаниннің тікелей ішуін көрсетеді, социологиялық жеңілдетудің стресс-моделінен депрессияны болдырмау үшін де тиімді.
- 00: 33: 01 - нейродегенерация бөлімінің басы.
- 00: 33: 30 - сульфорфан және Альцгеймер ауруы.
- 00: 33: 44 - Сульфорфан және Паркинсон ауруы.
- 00: 33: 51 - Сульфорфан және Хантингтон ауруы.
- 00: 34: 13 - Сульфорфан жылу әсерін арттырады.
- 00: 34: 43 - бас миының зақымдану секциясының басы.
- 00: 35: 01 - Туберкулезге қарсы тестілеуден кейін бірден сульфорфан препараты (тышқанның зерттеуі).
- 00: 35: 55 - сульфорфан және нейрондық пластика.
- 00: 36: 32 - Сулфорафан тышқандар типіндегі II типті қант диабеті моделін үйренуді жақсартады.
- 00: 37: 19 - сульфорфан және дученне бұлшықет дистрофиясы.
- 00: 37: 44 - Бұлшықет спутниктік жасушаларында миостатиннің ингибициясы (in vitro).
- 00: 38: 06 - Кешіктіріп бейнелеу: өлім және қатерлі ісік, ДНҚ зақымдануы, тотығу стресті және қабыну, бензолдың экскрециясы, жүрек-қан тамырлары аурулары, II типті диабет, миға әсер ету (депрессия, аутизм, шизофрения, нейрогенерация), NRF2 жолдары.
- 00: 40: 27 - брокколи өскіндер немесе сульффоранның дозасын анықтау туралы ойлар.
- 00: 41: 01 - Үйде өсіруге арналған анекдоттар.
- 00: 43: 14 - Пісіру температуралары және сульфарфан белсенділігі туралы.
- 00: 43: 45 - Глюкорафаниннен сульффоранның Gut бактерияларына айналуы.
- 00: 44: 24 - Көкөністерден белсенді мирозиназмен үйлескен кезде қоспалар жақсы жұмыс істейді.
- 00: 44: 56 - пісіру әдісі және крест тәрізді көкөністер.
- 00: 46: 06 - изотиоцианаттар букитогенттер ретінде.
Алғыс
Sciencedirect.com/science/article/pii/S2213231716302750
Сульфорафан қалай өндіріледі?
Қыздыру эпитиоспецификатор ақуызының белсенділігін төмендетеді және брокколиде сульфорафан түзілуін арттырады
дерексіз
Сульфорафан, брокколиден алынған изотиоцианат, тағамнан алынатын ең күшті антикарциногендердің бірі болып табылады. Бұл қосылыс бүлінбеген көкөністе болмайды, ол брокколи ұлпасын ұсақтағанда немесе шайнағанда оның глюкозинолат прекурсоры, глюкорафаниннен тиоглюкозидаза ферменті мирозиназаның әсерінен түзіледі. Дегенмен, бірқатар зерттеулер глюкорафаниннен сульфорафан шығымы төмен екенін және биоактивті емес нитрил аналогы сульфорафан нитрилінің өсімдік ұлпасын бөлме температурасында ұсақтаған кездегі гидролиздің негізгі өнімі екенін көрсетті. Соңғы дәлелдер Арабидопсисте глюкозинолаттардан нитрил түзілуін ыстыққа сезімтал протеин, эпитиоспецификатор протеині (ESP), мирозиназаның каталитикалық емес кофакторы басқаратынын көрсетеді. Біздің мақсатымыз брокколи гүлдері мен өскіндерін қыздырудың сульфорафан мен сульфорафан нитрилінің түзілуіне әсерін зерттеу, брокколиде ESP белсенділігінің бар-жоғын анықтау, содан кейін ESP белсенділігінің, сульфорафан мазмұнының және биоактивтіліктің индукциясымен өлшенетін ыстыққа тәуелді өзгерістерін корреляциялау болды. жасуша культурасындағы хинонредуктаза (QR) детоксикациясының II фазасы. Жаңа піскен брокколи гүлдерін немесе брокколи өскіндерін гомогенизациялау алдында 60 °C дейін қыздыру бір уақытта сульфорафан түзілуін арттырады және сульфорафан нитрилінің түзілуін азайтады. ESP белсенділігінің айтарлықтай жоғалуы сульфорафан нитрилінің түзілуінің төмендеуіне параллель болды. 70 °C және одан жоғары температураға дейін қыздыру брокколи гүлінде екі өнімнің түзілуін азайтты, бірақ брокколи өскіндерінде емес. Тінтуірдің өсірілген гепатомасының Hepa lclc7 жасушаларында QR индукциясы сульфорафан түзілуінің жоғарылауына параллельді.

Брокколи гүлдері мен өскіндерін 60 ºC дейін алдын ала қыздыру ұсақталғаннан кейін өсімдік ұлпаларының сығындыларында сульфорафанның (SF) мирозиназа катализді түзілуін айтарлықтай арттырды. Бұл сульфорафан нитрилінің (SF Nitrile) түзілуінің және эпитиоспецификатор ақуызының (ESP) белсенділігінің төмендеуімен байланысты болды.
Түйінді сөздер: Брокколи, Brassica oleracea, Cruciferae, Қатерлі ісік, Антикарциноген, Сульфорафан, Сульфорафан нитрил, Эпитиоспецификатор ақуызы, Хинонредуктаза
Қорытындылай келе, сульфорафан - брокколиде және басқа крестгүлді көкөністерде кездесетін фитохимиялық зат. Ішкі және сыртқы факторлардың әсерінен болатын бақыланбайтын тотықтырғыштардың мөлшері адам ағзасында тотығу стрессін тудыруы мүмкін, бұл ақыр соңында әртүрлі денсаулық мәселелеріне әкелуі мүмкін. Сульфорафан жасушаның тотықтырғыштарға реакциясын бақылайтын антиоксиданттық қорғаныс механизмдерін реттеуге көмектесетін транскрипция факторы Nrf2 өндірісін белсендіре алады. Біздің ақпаратымыздың көлемі хиропротикалық және омыртқаның денсаулығына қатысты мәселелермен шектеледі. Тақырыпты талқылау үшін доктор Хименеске хабарласыңыз немесе бізге телефон арқылы хабарласыңыз915-850-0900 .
Доктор Алекс Хименес мырзаның жетекшілігімен
Сілтеме: Sciencedirect.com

Қосымша тақырыпты талқылау: Жедел арқа ауруы
Арқа ауруыWorldwide бұл мүгедектіктің ең көп таралған себептерінің бірі және бүкіл әлемде жұмыссыз қалған күндер. Арқадағы ауырсыну тек жоғарғы тыныс жолдарының инфекцияларымен санасқан дәрігерлерге жүгінудің екінші жалпы себебі болып табылады. Халықтың шамамен 80 пайызы өмір бойы кем дегенде бір рет арқа ауруы болады. Омыртқа - бұл басқа жұмсақ тіндермен қатар сүйектерден, буындардан, байламдардан және бұлшықеттерден тұратын күрделі құрылым. Осыған байланысты жарақаттар және / немесе ауырлататын жағдайлар, мысалықатты дискілер, ақыр соңында арқа ауырсыну белгілеріне алып келуі мүмкін. Спорттық жарақаттар немесе автомобиль апатының жарақаттары көбінесе арқадағы ауырсынудың жиі себебі болып табылады, бірақ кейде ең қарапайым қозғалыстың ауыр нәтижесі болуы мүмкін. Бақытымызға орай, широпрактикалық күтім сияқты альтернативті емдеу параметрлері омыртқаның түзетуін және манипуляцияларды қолдану арқылы ауырсынуды жеңілдетуге көмектеседі, ақыр соңында ауруды жеңілдетеді.

EXTRA EXTRA | МАҢЫЗДЫ ТАҚЫРЫП: Ұсынылатын El Paso, TX Chiropractor
***
Мұндағы ақпарат «Сульфорафан дегеніміз не?" білікті денсаулық сақтау маманымен немесе лицензиясы бар дәрігермен жеке қарым-қатынасты ауыстыруға арналмаған және медициналық кеңес емес. Біз сізді зерттеулеріңізге және білікті денсаулық сақтау маманымен серіктестікке негізделген денсаулық сақтау туралы шешім қабылдауға шақырамыз.
Блог туралы ақпарат және ауқымды талқылау
Біздің ақпараттық шеңберіміз хиропрактика, тірек-қимыл аппараты, физикалық дәрі-дәрмектер, сауықтыру, этиологиялық әсер етумен шектеледі. висцеросоматикалық бұзылулар клиникалық көрсетілімдер, соматовисцеральды рефлекстің клиникалық динамикасы, сублюксация кешендері, денсаулыққа қатысты сезімтал мәселелер және/немесе функционалдық медицина мақалалары, тақырыптары және талқылаулары.
Біз қамтамасыз етеміз және ұсынамыз клиникалық ынтымақтастық түрлі сала мамандарымен. Әрбір маман өзінің кәсіби тәжірибесімен және лицензиялау юрисдикциясымен реттеледі. Біз тірек-қимыл аппаратының жарақаттары мен бұзылыстарын емдеу және қолдау үшін денсаулық пен сауықтыру функционалдық протоколдарын қолданамыз.
Біздің бейнелеріміз, жазбаларымыз, тақырыптарымыз, тақырыптарымыз және түсініктемелеріміз клиникалық тәжірибемізге тікелей немесе жанама түрде қатысты және оған қатысты мәселелерді, мәселелерді және тақырыптарды қамтиды*.
Біздің кеңсе дәлелді дәйексөздер беруге тырысты және біздің жазбаларымызды қолдайтын тиісті зерттеулерді немесе зерттеулерді анықтады. Сұраным бойынша біз бақылау кеңестеріне және қоғамға қол жетімді ғылыми зерттеулердің көшірмелерін ұсынамыз.
Біз оның белгілі бір күтім жоспарында немесе емдеу хаттамасында қалай көмектесе алатындығы туралы қосымша түсініктеме талап ететін мәселелерді қарастыратынымызды түсінеміз; сондықтан, жоғарыда аталған тақырыпты одан әрі талқылау үшін, сұраңыз Доктор Алекс Хименес, Колумбия округі, Немесе бізбен хабарласыңыз 915-850-0900.
Біз сізге және сіздің отбасыңызға көмектесу үшін осындамыз.
баталар
Доктор Алекс Хименес Тұрақты, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
электрондық пошта: train@elpasofunctionalmedicine.com
Хиропрактика докторы (DC) ретінде лицензияланған Техас & New Mexico*
Texas DC лицензиясы № TX5807, Нью-Мексико DC лицензиясы № NM-DC2182
Тіркелген медбике (RN*) лицензиясы бар in Флорида
Флорида лицензиясы RN лицензиясы # RN9617241 (Басқару №. 3558029)
Шағын күйі: Көп штаттық лицензия: Тәжірибе жасауға рұқсат етілген 40 штаттары*
Доктор Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Менің цифрлық визит карточкам






