Кетон денелерін бауыр жасайды және глюкоза адам ағзасында оңай қол жетімді болмаған кезде энергия көзі ретінде пайдаланылады. Екі негізгі кетон денесі - ацетоацетат (AcAc) және 3-бета-гидроксибутират (3HB), ал ацетон - үшінші және аз мөлшерде кетон денесі. Кетондар әрқашан қанда болады және олардың деңгейі ораза кезінде және ұзақ жаттығулар кезінде жоғарылайды.�Кетогенез май қышқылдары мен кетогендік аминқышқылдарының ыдырауы арқылы организмдер кетон денелерін түзетін биохимиялық процесс.
Кетон денелері негізінен қанда түзіледі бауыр жасушаларының митохондриялары. Кетогенез қандағы глюкоза деңгейі төмен болғанда, әсіресе гликоген сияқты басқа жасушалық көмірсулар қоры таусылғаннан кейін пайда болады. Бұл механизм инсулиннің жеткіліксіз мөлшері болған кезде де пайда болуы мүмкін. Кетон денелерінің өндірісі, сайып келгенде, адам ағзасында май қышқылдары ретінде сақталатын қолжетімді энергияны жасау үшін басталады. Кетогенез дербес реттелетін митохондрияда жүреді.
Мазмұны
дерексіз
Кетон организмінің метаболизмі физиологиялық гомеостаздың орталық түйіні болып табылады. Бұл шолуда біз кетондардың әртүрлі қоректік заттардың қалдықтарында орган мен ағзаның жұмысын оңтайландыратын және көптеген органдар жүйесіндегі қабыну мен жарақаттан қорғайтын дискретті дәл реттеу метаболизмдік рөлдерге қалай қызмет ететінін талқылаймыз. Дәстүрлі түрде тек көмірсулардың шектелуіне жататын метаболикалық субстраттар ретінде қарастырылатын соңғы бақылаулар көмірсулар көп болған кезде кетондық денелердің маңызды метаболизм және сигналдық медиаторлар ретінде маңыздылығын көрсетеді. Жүйке жүйесі ауруларының белгілі терапевтік нұсқаларының репертуарын толықтыра отырып, семіздік пен жүрек-қан тамырлары ауруларында терапевтік нұсқаларды ашатын жүрек пен бауырдағы қызықты қорғаныс рөлдері сияқты қатерлі ісіктегі кетон денелерінің перспективалық рөлдері пайда болды. Классикалық догмаларды қазіргі заманғы бақылаулармен үйлестіру үшін кетон метаболизмі мен сигнализациясындағы қайшылықтар талқыланады.
кіріспе
Кетон денелері өмірдің барлық салалары, эукария, бактериялар және археялар үшін маңызды балама метаболикалық отын көзі болып табылады (Aneja және басқалар, 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Адамдардағы кетон организмінің метаболизмі қоректік заттардың жетіспеушілігінің эпизодтық кезеңдерінде миды қуаттандыру үшін пайдаланылды. Кетон денелері сүтқоректілердің ?-тотығуы (ФАО), трикарбон қышқылының циклі (TCA), глюконеогенез, де жаңа липогенез (DNL) және стеролдар биосинтезі сияқты маңызды метаболикалық жолдармен біріктірілген. Сүтқоректілерде кетон денелері негізінен ФАО-дан алынған ацетил-КоА-дан бауырда түзіледі және олар терминалдық тотығу үшін бауырдан тыс тіндерге тасымалданады. Бұл физиология май қышқылдарының қолжетімділігін арттыратын және көмірсулардың қолжетімділігін төмендететін салыстырмалы түрде қысқа аштық кезеңдерімен толықтырылатын балама отынмен қамтамасыз етеді (Кэйхилл GF Jr, 2006; McGarry and Foster, 1980; Robinson and Williamson, 1980). Кетон денесінің тотығуы ораза, аштық, неонаталдық кезең, жаттығудан кейінгі, жүктілік және төмен көмірсулар диеталарын ұстануды қоса алғанда, көптеген физиологиялық күйлерде бауырдан тыс тіндердегі сүтқоректілердің жалпы энергетикалық метаболизміне маңызды үлес қосады. Дені сау ересек адамдардағы айналымдағы кетон денесінің жалпы концентрациясы әдетте шамамен 100–250 μM аралығындағы тәуліктік тербелістерді көрсетеді, ұзақ жаттығулардан немесе 1 сағаттық аштықтан кейін ~24 мМ-ге дейін көтеріледі және диабеттік кетоацидоз сияқты патологиялық жағдайларда 20 мм-ге дейін жиналуы мүмкін. Cahill GF Jr, 2006; Johnson және басқалар, 1969b; Koeslag және басқалар, 1980; Robinson and Williamson, 1980; Wildenhoff et al., 1974). Адам бауыры тәулігіне 300 г кетон денелерін шығарады (Balasse және Fery, 1989), олар тамақтанған, ашқан және аштық жағдайында жалпы энергия шығынының 5-20% құрайды (Balasse және басқалар, 1978; Кокс және басқалар. т.б., 2016).
Соңғы зерттеулер сүтқоректілердің жасушаларының метаболизміндегі, гомеостаздағы және әртүрлі физиологиялық және патологиялық күйлердегі сигнал берудегі кетон денелерінің маңызды рөлдерін көрсетеді. Ми, жүрек немесе қаңқа бұлшықеттері сияқты бауырдан тыс тіндерге энергия отын ретінде қызмет етуден басқа, кетон денелері сигналдық медиаторлар, ақуыздың трансляциядан кейінгі модификациясының (PTM) драйверлері және қабыну мен тотығу стрессінің модуляторлары ретінде маңызды рөл атқарады. Бұл шолуда біз кетон денелерінің плейотропты рөлдері мен олардың метаболизмі туралы классикалық және заманауи көзқарастарды береміз.
Кетон организмінің метаболизміне шолу
Бауыр кетогенезінің жылдамдығы майдың физиологиялық және биохимиялық трансформацияларының реттелген сериясымен реттеледі. Бастапқы реттегіштерге триацилглицериндерден май қышқылдарының липолизі, гепатоциттердің плазмалық мембранасына және арқылы тасымалдануы, карнитин пальмитоилтрансфераза 1 (CPT1) арқылы митохондрияға тасымалдануы, ?-тотығу спиралі, TCA циклінің белсенділігі және аралық концентрациялар, тотығу-тотықсыздандырғыш потенциалы, гормондық потенциалдар жатады. осы процестердің, негізінен, глюкагон және инсулин [қаралған (Arias және басқалар, 1995; Айте және басқалар, 1993; Ehara және басқалар, 2015; Ferre және басқалар, 1983; Кан және басқалар, 2005; МакГарри және Фостер). , 1980; Williamson және т.б., 1969)]. Классикалық түрде кетогенез ацетил-КоА тотығудан алынған цитрат синтаза белсенділігінен және/немесе цитрат түзу үшін конденсациялану үшін оксалоацетаттың қолжетімділігінен асып түсетін таралу жолы ретінде қарастырылады. Үш көміртекті аралық өнімдер ацетил-КоА тұтыну үшін оксалоацетат пулын кеңейту қабілетіне байланысты антикетогендік белсенділікті көрсетеді, бірақ тек бауырдағы ацетил-КоА концентрациясы кетогендік жылдамдықты анықтамайды (Foster, 1967; Rawat және Menahan, 1975; Уильямсон және т.б., 1969). Кетогенезді гормондық, транскрипциялық және трансляциядан кейінгі оқиғалар арқылы реттеу бірге кетогендік жылдамдықты дәл баптайтын молекулалық механизмдер әлі толық түсінілмеген деген түсінікті қолдайды (HMGCS2 және SCOT/OXCT1 реттеуін қараңыз).
Кетогенез негізінен бауырдың митохондриялық матрицасында майдың жалпы тотығуына пропорционалды жылдамдықпен жүреді. Ацил тізбегі митохондриялық мембраналар арқылы тасымалданғаннан кейін және ?-тотығудан кейін 3-гидроксиметилглутарил-КоА синтазасының (HMGCS2) митохондриялық изоформасы ацетоацетил-КоА (AcAc-CoA) конденсациясын және H-AM генерациясын тудыратын тағдырды катализдейді. (Cурет 1А). HMG-CoA лиазасы (HMGCL) ацетил-КоА мен ацетоацетатты (AcAc) босату үшін HMG-CoA-ны ыдыратады, ал соңғысы фосфатидилхолинге тәуелді митохондриялық дегидрогеназа (D-OHB) арқылы d-?-гидроксибутиратқа (d-?OHB) дейін тотықсызданады. BDH1) NAD+/NADH-байланысқан жақын тепе-теңдік реакциясында (Bock and Fleischer, 1975; LEHNINGER et al., 1960). BDH1 тепе-теңдік константасы d-?OHB өндірісін қолдайды, бірақ AcAc/d-?OHB кетон денелерінің арақатынасы митохондриялық NAD+/NADH қатынасына тура пропорционал, сондықтан BDH1 оксидоредуктазасының белсенділігі митохондриялық тотығу-тотықсыздану потенциалын модуляциялайды (Кребс және т.б., 1969; Уильямсон және т.б., 1967). AcAc сонымен қатар кетоацидозбен ауыратын адамдарда тәтті иістің көзі болып табылатын ацетонға (Педерсен, 1929) өздігінен декарбоксилденуі мүмкін (яғни сарысудағы жалпы кетон денелері > ~7 мМ; AcAc pKa 3.6, ?OHB pKa 4.7). Кетон денелерінің митохондриялық ішкі мембрана арқылы тасымалдануының механизмдері белгісіз, бірақ AcAc/d-?OHB жасушалардан монокарбоксилат тасымалдаушылары арқылы шығарылады (сүтқоректілерде, MCT 1 және 2, сондай-ақ еріген затты тасымалдаушы 16A отбасы мүшелері 1 және 7) және терминалдық тотығу үшін бауырдан тыс тіндерге айналымда тасымалданады (Cotter және басқалар, 2011; Halestrap және Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Айналымдағы кетон денелерінің концентрациясы бауырдан тыс тіндерге қарағанда жоғары (Харрисон және Лонг, 1940), бұл кетон денелерінің концентрация градиентімен төмен тасымалдануын көрсетеді. MCT1-дегі функцияны жоғалту мутациялары кетоацидоздың өздігінен пайда болуымен байланысты, бұл кетон денесінің импортында маңызды рөл атқарады.
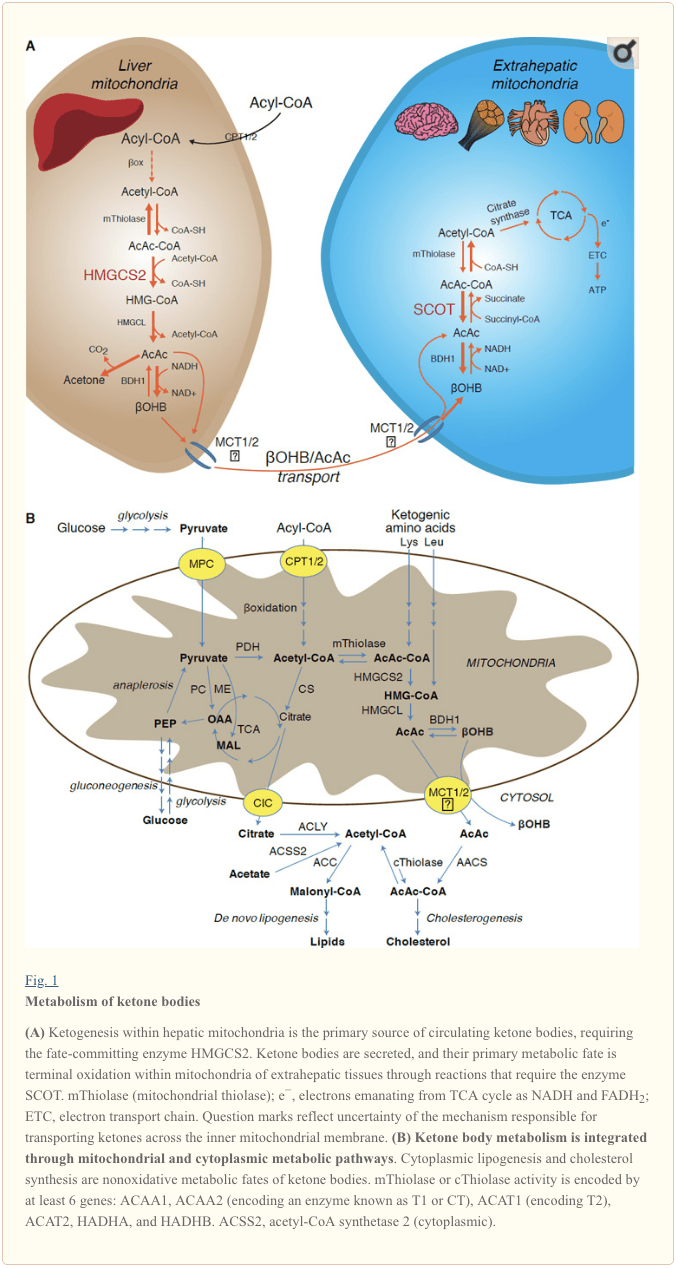
� Кетон денелерінің тотығуға ұшырамайтын тағдырларға потенциалды ауысуын қоспағанда («Кетон денелерінің тотығусыз метаболикалық тағдыры» бөлімін қараңыз), гепатоциттерде олар түзетін кетон денелерін метаболиздеу қабілеті жоқ. Бауырмен де жаңадан синтезделген кетондық денелер (i) бауырдан тыс тіндердің митохондрияларында терминалдық тотығу үшін TCA циклінде қол жетімді ацетил-КоА-ға дейін катаболизденеді (1А-сурет), (ii) липогенезге немесе стерол синтезінің жолдарына бұрылады ( 1В-сурет) немесе (iii) несеппен шығарылады. Баламалы энергетикалық отын ретінде кетон денелері жүректе, қаңқа бұлшықетінде және мида қатты тотығады (Balasse және Fery, 1989; Bentourkia және т. ). Бауырдан тыс митохондриялық BDH2009 OHB тотығуының бірінші реакциясын катализдейді, оны AcAc кері түрлендіреді (LEHNINGER және басқалар, 1967; Сандерман және басқалар, 1974). Цитоплазмалық d-?OHB-дегидрогеназаның (BDH1988) BDH1-ге тек 1960% дәйектілігі бар, кетон денелері үшін жоғары Km бар, сонымен қатар темір гомеостазында рөл атқарады (Давулури және басқалар, 1986; Гуо және т.б., 2) . Бауырдан тыс митохондриялық матрицада AcAc сүтқоректілердің бірегей КоА трансферазасы, сукцинил-КоА:20-оксоқышқыл-КоА трансферазасы (SCOT, CoA трансфераза) катализдейтін реакцияда сукцинил-КоА-дан КоА-бөлімінің алмасуы арқылы AcAc-CoA-ға дейін белсендіріледі; OXCT1 арқылы кодталған), жақын тепе-теңдік реакциясы арқылы. AcAc-CoA гидролизі арқылы бөлінетін бос энергия сукцинил-КоА энергиясынан жоғары, бұл AcAc түзілуіне қолайлы. Осылайша, кетон денесінің тотығу ағыны массалық әсерге байланысты пайда болады: AcAc мол қоры және цитрат синтаза арқылы ацетил-КоА жылдам тұтынылуы SCOT арқылы AcAc-CoA (+ сукцинат) түзілуіне ықпал етеді. Атап айтқанда, глюкозадан (гексокиназа) және май қышқылдарынан (ацил-КоА синтетазаларынан) айырмашылығы, кетон денелерінің (SCOT) тотығатын түрге активтенуі АТФ инвестициясын қажет етпейді. Қайтымды AcAc-CoA тиолаза реакциясы [ACAA2016 (T2006 немесе CT деп аталатын ферментті кодтайтын), ACAT3 (T1 кодтауы), HADHA немесе HADHB арқылы кодталған төрт митохондриялық тиолазаның кез келгенімен катализделген] екі ацетил-КоА молекуласын береді, олар TCA цикліне енеді (Hersh and Jencks, 2; Stern et al., 1; Williamson et al., 1). Кетотикалық күйлер кезінде (яғни, сарысудағы кетондардың жалпы мөлшері > 2 μM) кетон денелері энергия шығынының маңызды үлесіне айналады және тотығуды сіңіру немесе қанықтыру орын алғанша тіндерде тез пайдаланылады (Balasse және басқалар, 1967; Баласс және Фери, 1956). Эдмонд және т.б., 1971). Бауырдан алынған кетон денелерінің өте аз бөлігі несепте оңай өлшенуі мүмкін, ал бүйрек арқылы пайдалану және реабсорбция жылдамдығы айналымдағы концентрацияға пропорционалды (Голдштейн, 500; Робинсон және Уильямсон, 1978). Жоғары кетотикалық күйлер кезінде (плазмада > 1989 мМ) кетонурия кетоздың жартылай сандық репортері ретінде қызмет етеді, дегенмен зәрдегі кетон денелерінің клиникалық талдауларының көпшілігі AcAc анықтайды, бірақ ?OHB емес (Klocker et al., 1987).
Кетогендік субстраттар және олардың гепатоциттердің метаболизміне әсері
Кетогенді субстраттарға май қышқылдары мен аминқышқылдары жатады (1В-сурет). Амин қышқылдарының, әсіресе лейциннің катаболизмі сіңуден кейінгі күйде кетон денелерінің шамамен 4% құрайды (Томас және т.б., 1982). Осылайша, кетон денелерін генерациялау үшін ацетил-КоА субстрат пулы негізінен май қышқылдарынан туындайды, өйткені көмірсулармен қамтамасыз етудің төмендеуі жағдайында пируват бауырдың TCA цикліне ең алдымен анаплероз арқылы, яғни оксалоацетатқа (OAA) немесе малатқа АТФ-тәуелді карбоксилдену арқылы енеді. (MAL) және ацетил-КоА-ға тотығу декарбоксилдену емес (Jeoung және басқалар, 2012; Magnusson және басқалар, 1991; Merritt және басқалар, 2011). Бауырда глюкоза мен пируват кетогенезге елеусіз үлес қосады, тіпті пируваттың ацетил-КоА-ға декарбоксилденуі максималды болса да (Jeoung және басқалар, 2012).
Ацетил-КоА терминалдық тотығу арқылы АТФ генерациясынан тыс бауырдағы аралық метаболизмнің интегралды бірнеше рөлін атқарады (сонымен қатар кетон денесінің метаболизмінің интеграциясы, трансляциядан кейінгі модификация және жасуша физиологиясы бөлімін қараңыз). Ацетил-КоА (i) пируват карбоксилазаны (ПК) аллостерикалық түрде белсендіреді, осылайша метаболиттердің TCA цикліне анаплеротикалық енуін күшейтетін метаболизмді басқару механизмін белсендіреді (Оуэн және басқалар, 2002; Скруттон және Уттер, 1967) және (ii) пируатете. пируватдегидрогеназаны (PDH) фосфорлайды және тежейтін киназа (Купер және т.б., 1975), осылайша анаплероз арқылы TCA цикліне пируват ағынын одан әрі күшейтеді. Сонымен қатар, пулы митохондриялық ацетил-КоА-ны тасымалданатын метаболиттерге айналдыратын механизмдер арқылы ұлғайтылатын цитоплазмалық ацетил-КоА май қышқылының тотығуын тежейді: ацетил-КоА карбоксилаза (ACC) ацетил-КоА-ның малонил-КоА субстратына айналуын катализдейді, және митохондриялық CPT1 аллостериялық ингибиторы [қаралған (Кан және басқалар, 2005; МакГарри және Фостер, 1980)]. Осылайша, митохондриялық ацетил-КоА пулы бауырдағы делдалдық метаболизмнің негізгі аспектілерін реттейтін кетогенездің таралу жолы арқылы реттеледі және реттеледі.
Кетон денелерінің тотығусыз метаболикалық тағдырлары
Бауырдан алынатын кетондардың басым тағдыры SCOT-тәуелді бауырдан тыс тотығу болып табылады. Дегенмен, AcAc митохондриялардан экспортталады және цитоплазмалық ацетоацетил-КоА синтетазасымен катализделген ATP-тәуелді реакция арқылы AcAc-CoA-ға айналу арқылы анаболикалық жолдарда пайдаланылуы мүмкін (AACS, 1В-сурет). Бұл жол мидың дамуы кезінде және емізетін сүт безінде белсенді болады (Моррис, 2005; Робинсон және Уильямсон, 1978; Охгами және т.б., 2003). AACS сонымен қатар май тінінде және белсендірілген остеокласттарда жоғары деңгейде көрінеді (Aguilo және басқалар, 2010; Yamasaki және басқалар, 2016). Цитоплазмалық AcAc-CoA цитозолдық HMGCS1 арқылы стерол биосинтезіне бағытталуы немесе екі цитоплазмалық тиолазаның кез келгені арқылы ацетил-КоА-ға (ACAA1 және ACAT2) ыдырауы, малонил-КоА-ға карбоксилдену және май қышқылдарының синтезіне ықпал етуі мүмкін. т.б., 1984; Эдмонд, 1974; Endemann және басқалар, 1982; Гилен және басқалар, 1983; Веббер және Эдмонд, 1977).
Физиологиялық маңызы әлі анықталмағанымен, кетондар тіпті бауырда анаболикалық субстраттар ретінде қызмет ете алады. Жасанды эксперименттік контексттерде AcAc жаңадан синтезделген липидтердің жартысына дейін және жаңа синтезделген холестериннің 75% дейін үлес қоса алады (Endemann және басқалар, 1982; Geelen және басқалар, 1983; Freed және басқалар, 1988). AcAc бауыр майының толық емес тотығуынан алынғандықтан, AcAc липогенезге in vivo ықпал ету қабілеті бауырдың пайдасыз циклін білдіреді, мұнда майдан алынған кетондар липидтерді өндіру үшін пайдаланылуы мүмкін, физиологиялық маңызы эксперименталды тексеруді қажет ететін ұғым. бейімделгіш немесе бейімделмейтін рөлдер (Солинас және т.б., 2015). AcAc төмен AACS Km-AcAc (~50 μM) бар холестерогенезді жақсы қамтамасыз етеді, тіпті қоректік күйде де AcAc белсендірілуін қамтамасыз етеді (Бергстром және басқалар, 1984). Цитоплазмалық кетон метаболизмінің динамикалық рөлі тінтуірдің бастапқы эмбриондық нейрондарында және 3T3-L1 туынды-адипоциттерде ұсынылды, өйткені AACS нокдауы әрбір жасуша түрінің дифференциациясын бұзады (Хасегава және басқалар, 2012a; Хасегава және т.б., 2012b). Тышқандардағы AACS-ті in vivo күйге келтіру қан сарысуындағы холестеринді төмендетті (Хасегава және басқалар, 2012c). SREBP-2, холестерин биосинтезінің негізгі транскрипциялық реттеушісі және пероксисома пролифераторының белсендірілген рецепторы (PPAR)-? олар AACS транскрипциялық активаторлары болып табылады және нейриттің дамуы кезінде және бауырда оның транскрипциясын реттейді (Aguilo және басқалар, 2010; Хасегава және басқалар, 2012c). Бірге алғанда, цитоплазмалық кетон денесінің метаболизмі таңдаулы жағдайларда немесе аурудың табиғи тарихында маңызды болуы мүмкін, бірақ бауырдан алынған кетон денелерін жою үшін жеткіліксіз, өйткені массивті гиперкетонемия функцияның жоғалуы арқылы бастапқы тотығу тағдырының селективті бұзылуы жағдайында пайда болады. SCOT (Berry және т.б., 2001; Cotter және т.б., 2011).
HMGCS2 және SCOT/OXCT1 реттеуі
Митохондрияның цитозолдық HMGCS кодтайтын геннен алшақтығы мидың дене салмағына қатынасы жоғары түрлерде бауыр кетогенезін қолдау қажеттілігіне байланысты омыртқалылар эволюциясының басында орын алды (Boukaftane және басқалар, 1994; Cunnane және Crawford, 2003). Адамдарда табиғи түрде пайда болатын функцияны жоғалту HMGCS2 мутациялары гипокетотикалық гипогликемияны тудырады (Питт және басқалар, 2015; Томпсон және басқалар, 1997). Қатты HMGCS2 экспрессиясы гепатоциттермен және тоқ ішек эпителийімен шектелген және оның экспрессиясы мен ферментативті белсенділігі әртүрлі механизмдер арқылы үйлестіріледі (Mascaro және т.б., 1995; McGarry and Foster, 1980; Robinson and Williamson, 1980). HMGCS2-ге әсер ететін физиологиялық күйлердің толық ауқымы қосымша түсіндіруді қажет еткенімен, оның экспрессиясы және/немесе белсенділігі босанғаннан кейінгі ерте кезеңде, қартаюда, қант диабетінде, аштықта немесе кетогендік диетаны қабылдау кезінде реттеледі (Balasse and Fery, 1989; Cahill GF Jr, 2006). ; Girard және т.б., 1992; Hegardt, 1999; Satapati және басқалар, 2012; Sengupta және басқалар, 2010). Ұрықта Hmgcs5 генінің 2-қабат аймағының метилденуі оның транскрипциясымен кері байланыста болады және туғаннан кейін ішінара кері өзгереді (Arias және басқалар, 1995; Айте және басқалар, 1993; Ehara және т.б., 2015; Ферре және басқалар. ., 1983). Сол сияқты, бауыр Bdh1 туылғаннан емшектен шыққанға дейін өсетін даму экспрессиясының үлгісін көрсетеді, сонымен қатар кетогендік диета фибробласт өсу факторына (FGF) -21-ге тәуелді түрде индукцияланады (Бадман және басқалар, 2007; Чжан және т.б., 1989). ). Сүтқоректілердегі кетогенез инсулинге де, глюкагонға да жоғары жауап береді, сәйкесінше басылады және ынталандырылады (МакГарри және Фостер, 1977). Инсулин май тінінің липолизін басады, осылайша кетогенезді оның субстратынан айырады, ал глюкагон бауырға тікелей әсер ету арқылы кетогендік ағынды арттырады (Хегардт, 1999). Hmgcs2 транскрипциясы инсулин-фосфатидилинозит-2-киназа/Akt арқылы тежелетін және глюкагон-cAMP-p3 сигнализациясы арқылы индукцияланатын FOXA300 транскрипциялық факторымен ынталандырылады (Arias және т.б., 1995; Hegardt;ant, 1999). , 1990; Тумелин және т.б., 1993; фон Мейен және басқалар, 2013; Вольфрум және басқалар, 2004; Вольфрум және басқалар, 2003). PPAR? (Родригес және басқалар, 1994) өзінің мақсатымен бірге FGF21 (Бадман және басқалар, 2007) сонымен бірге аштық немесе кетогендік диетаны енгізу кезінде бауырда Hmgcs2 транскрипциясын тудырады (Бадман және басқалар, 2007; Инагаки және басқалар, 2007). ). PPAR индукциясы? ұрықтың физиологиясынан неонатальды физиологияға көшкенге дейін орын алуы мүмкін, ал FGF21 белсендіру гистон деацетилазасының (HDAC)-3 (Rando және т.б., 2016) OHB арқылы тежелуі арқылы ерте неонатальды кезеңде қолайлы болуы мүмкін. mTORC1 (рапамицин кешенінің сүтқоректілердің нысанасы 1) PPAR тәуелді тежелуі? транскрипциялық белсенділік сонымен қатар Hmgcs2 генінің экспрессиясының негізгі реттеушісі болып табылады (Sengupta және басқалар, 2010) және бауыр PER2, негізгі циркадиялық осциллятор, Hmgcs2 экспрессиясын жанама түрде реттейді (Chavan және басқалар, 2016). Соңғы бақылаулар бауырдан тыс ісік тудырған интерлейкин-6 PPAR арқылы кетогенезді нашарлататынын көрсетеді? басу (Flint et al., 2016).
HMGCS2 ферментінің белсенділігі бірнеше PTM арқылы реттеледі. HMGCS2 серинді фосфорлануы оның in vitro белсенділігін арттырды (Grimsrud et al., 2012). HMGCS2 белсенділігі сукцинил-КоА және лизин қалдығының сукцинилденуі арқылы аллостериялық түрде тежеледі (Arias және басқалар, 1995; Hegardt, 1999; Lowe және Tubbs, 1985; Quant және т.б., 1990; Rardin және басқалар, 2013; Реед және т. 1975; Тумелин және т.б., 1993). Бауыр митохондрияларындағы HMGCS2, HMGCL және BDH1 лизин қалдықтарының сукцинилденуі NAD+ тәуелді деацилаза сиртуин 5 (SIRT5) нысанасы болып табылады (Rardin және басқалар, 2013). HMGCS2 белсенділігі SIRT3 лизин деацетилденуі арқылы да жақсарады және ацетилдену мен сукцинилдену арасындағы айқас HMGCS2 белсенділігін реттейтін болуы мүмкін (Rardin және басқалар, 2013; Шимазу және басқалар, 2013). Бұл PTM-лердің HMGCS2 Km және Vmax реттеу қабілетіне қарамастан, бұл PTM-лердің ауытқулары әлі мұқият карталанбаған және in vivo кетогенездің механикалық драйверлері ретінде расталмаған.
SCOT гепатоциттерден басқа, митохондриялары бар сүтқоректілердің барлық жасушаларында көрінеді. SCOT белсенділігі мен кетолиздің маңыздылығы туылғаннан кейін 48 сағат ішінде гиперкетонемиялық гипогликемияға байланысты біркелкі өлімге әкелетін SCOT-KO тышқандарында көрсетілді (Cotter et al., 2011). Нейрондарда немесе қаңқалық миоциттерде тінге тән SCOT жоғалуы аштық кезінде метаболикалық бұзылуларды тудырады, бірақ өлімге әкелмейді (Cotter et al., 2013b). Адамдарда SCOT тапшылығы өмірдің басында ауыр кетоацидозбен бірге жүреді, бұл летаргия, құсу және комаға әкеледі (Берри және басқалар, 2001; Фукао және басқалар, 2000; Кассовска-Братинова және басқалар, 1996; Низен-Конинг және т.б. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon and Cornblath, 1972). SCOT гені мен ақуыз экспрессиясының реттегіштері туралы жасушалық деңгейде салыстырмалы түрде аз белгілі. Oxct1 mRNA экспрессиясы және SCOT ақуызы мен белсенділігі кетотикалық күйлерде, мүмкін PPAR-тәуелді механизмдер арқылы төмендейді (Фенселау және Уоллис, 1974; Фенселау және Уоллис, 1976; Гринблат және басқалар, 1986; Окуда және басқалар, 1991; Турко және т.б. ., 2001; Wentz және т.б., 2010). Диабеттік кетоацидозда бауыр кетогенезі мен бауырдан тыс тотығу арасындағы сәйкессіздік SCOT белсенділігінің бұзылуымен күшейеді. Кардиомиоциттерде инсулинге тәуелсіз глюкоза тасымалдаушысының (GLUT1/SLC2A1) шамадан тыс экспрессиясы Oxct1 генінің экспрессиясын тежейді және кетотикалық емес күйде кетондардың терминалдық тотығуын төмендетеді (Ян және басқалар, 2009). Бауырда Oxct1 мРНҚ көптігі микроРНҚ-122 және гистон метилденуі H3K27me3 арқылы басылады, бұл ұрықтан неонаталдық кезеңге өту кезінде айқын көрінеді (Торрез және басқалар, 2011). Дегенмен, босанғаннан кейінгі кезеңде бауырдағы Oxct1 экспрессиясының басылуы, ең алдымен, терминалдық дифференциацияланған гепатоциттерде бұрын бар Oxct1 экспрессиясының жоғалуымен емес, Oxct1-экспрессиялайтын гемопоэтикалық ізашарлардың бауырдан эвакуациялануымен байланысты. Іс жүзінде, Oxct1 мРНҚ және SCOT протеинінің дифференциалданған гепатоциттерде экспрессиясы өте төмен (Orii және басқалар, 2008).
SCOT сонымен қатар PTM арқылы реттеледі. Фермент SIRT3 KO тышқандарының миында гиперацетилденген, ол сонымен қатар AcAc тәуелді ацетил-КоА өндірісінің төмендеуін көрсетеді (Диттенхафер-Рид және т.б., 2015). SCOT тирозин қалдықтарының ферментативті емес нитрленуі де оның белсенділігін төмендетеді, бұл әртүрлі диабеттік тышқан үлгілерінің жүректерінде хабарланған (Маркондес және басқалар, 2001; Турко және басқалар, 2001; Ванг және басқалар, 2010a). Керісінше, триптофан қалдығын нитрлеу SCOT белсенділігін арттырады (Br gère және т.б., 2010; Ребрин және т.б., 2007). SCOT белсенділігін модуляциялауға арналған қалдыққа тән нитрлеудің немесе денитрлеудің молекулалық механизмдері болуы мүмкін және түсіндіруді қажет етеді.
Бауырдан тыс кетогенездегі қайшылықтар
Сүтқоректілерде негізгі кетогендік орган бауыр болып табылады және тек гепатоциттер мен ішек эпителий жасушалары HMGCS2 митохондриялық изоформасын көп көрсетеді (Cotter және басқалар, 2013a; Cotter және басқалар, 2014; McGarry және Foster, 1980; Робинсон және Уильямсон, 1980) . Күрделі полисахаридтердің анаэробты бактериялық ашытуы колоноциттердің дифференциациясында рөл атқаруы мүмкін сүтқоректілердегі колоноциттермен терминалдық тотығу немесе кетогенез үшін сіңетін бутират береді (Чербуй және т.б., 1995). Ішек эпителий жасушалары мен гепатоциттерді қоспағанда, HMGCS2016 сүтқоректілердің барлық дерлік жасушаларында жоқ, бірақ ісік жасушаларында, орталық жүйке жүйесінің астроциттерінде, бүйректе, ұйқы безінде бауырдан тыс кетогенездің перспективасы жоғарылады. жасушалар, ретинальды пигментті эпителий (RPE) және тіпті қаңқа бұлшықетінде (Adijanto және басқалар, 2; Avogaro және басқалар, 2014; El Azzouny және басқалар, 1992; Grabacka және басқалар, 2016; Канг және басқалар, 2016). ; Ле Фолл және басқалар, 2015; Нонака және басқалар, 2014; Такаги және басқалар, 2016a; Thevenet және басқалар, 2016; Чжан және басқалар, 2016). Эктопиялық HMGCS2011 таза кетогендік қабілеті жоқ тіндерде байқалды (Кук және басқалар, 2; Вентц және басқалар, 2016) және HMGCS2010 болашақ кетогенезге тәуелсіз, соның ішінде жасуша ядросында (Чен және т.б.). , 2; Kostiuk және т.б., 2016; Meertens және т.б., 2010).
Кетон денелерін тотықтыратын кез келген бауырдан тыс тіндердің де HMGCS2 тәуелсіз механизмдері арқылы кетон денелерін жинақтау мүмкіндігі бар (2А-сурет). Дегенмен, кетон денелерінің тұрақты күйдегі концентрациясы қан айналымынан асатын бауырдан тыс тін жоқ (Cotter және басқалар, 2011; Cotter және басқалар, 2013b; Харрисон және Лонг, 1940), бұл кетон денелерінің төмен қарай тасымалданатынын атап көрсетеді. MCT1/2-тәуелді механизмдер арқылы концентрация градиенті. Бауырдан тыс кетогенездің бір механизмі шын мәнінде кетон тотығуының салыстырмалы бұзылуын көрсетуі мүмкін. Қосымша ықтимал түсініктемелер кетон денесінің пайда болу саласына жатады. Біріншіден, де жаңа кетогенез тиолаза мен SCOT-тың қайтымды ферментативті белсенділігі арқылы болуы мүмкін (Weidemann and Krebs, 1969). Ацетил-КоА концентрациясы салыстырмалы түрде жоғары болған кезде, әдетте AcAc тотығуына жауапты реакциялар кері бағытта әрекет етеді (GOLDMAN, 1954). Екінші механизм ?-тотығудан алынған аралық өнімдер TCA циклінің кедергісіне байланысты жинақталғанда, AcAc-CoA митохондриялық 3-гидроксиацил-КоА дегидрогеназасымен, одан әрі 3-гидроксибутирилмен катализделген реакция арқылы l-?OHB-CoA-ға айналады. КоА деацилазадан l-?OHB-ге дейін, ол масс-спектрометрия немесе резонансты спектроскопия арқылы d-?OHB физиологиялық энантиомерінен айырмашылығы жоқ (Рид және Озанд, 1980). l-?OHB хроматографиялық немесе ферментативті түрде d-?OHB-ден ажыратылуы мүмкін және бауырдан немесе қанда емес, бауырдан тыс тіндерде болады (Hsu et al., 2011). Бауырдың кетогенезі тек d-?OHB, BDH субстраты болып табылатын жалғыз энантиомерді шығарады (Ito және басқалар, 1984; Линкольн және басқалар, 1987; Рид және Озанд, 1980; Скофилд және басқалар, 1982; Скофилд және т.б., 1982). Үшінші HMGCS2-тәуелсіз механизм аминқышқылдарының, атап айтқанда лейцин мен лизиннің катаболизмі арқылы d-?OHB түзеді. Төртінші механизм тек айқын, себебі ол таңбалау артефактіне байланысты және осылайша псевдокетогенез деп аталады. Бұл құбылыс SCOT және тиолаза реакцияларының қайтымдылығымен байланысты және бауырдан тыс тіндерде кетон денесінің тракерінің изотоптық сұйылтуына байланысты кетон денесінің айналымын асыра бағалауды тудыруы мүмкін (Des Rosiers және басқалар, 1990; Финк және басқалар, 1988) . Дегенмен, псевдокетогенез көптеген контексттерде елеусіз болуы мүмкін (Bailey және басқалар, 1990; Келлер және басқалар, 1978). Схема (2А-сурет) кетондардың тіндердің тұрақты концентрациясының жоғарылауын ескере отырып, қолданудың пайдалы әдісін көрсетеді.
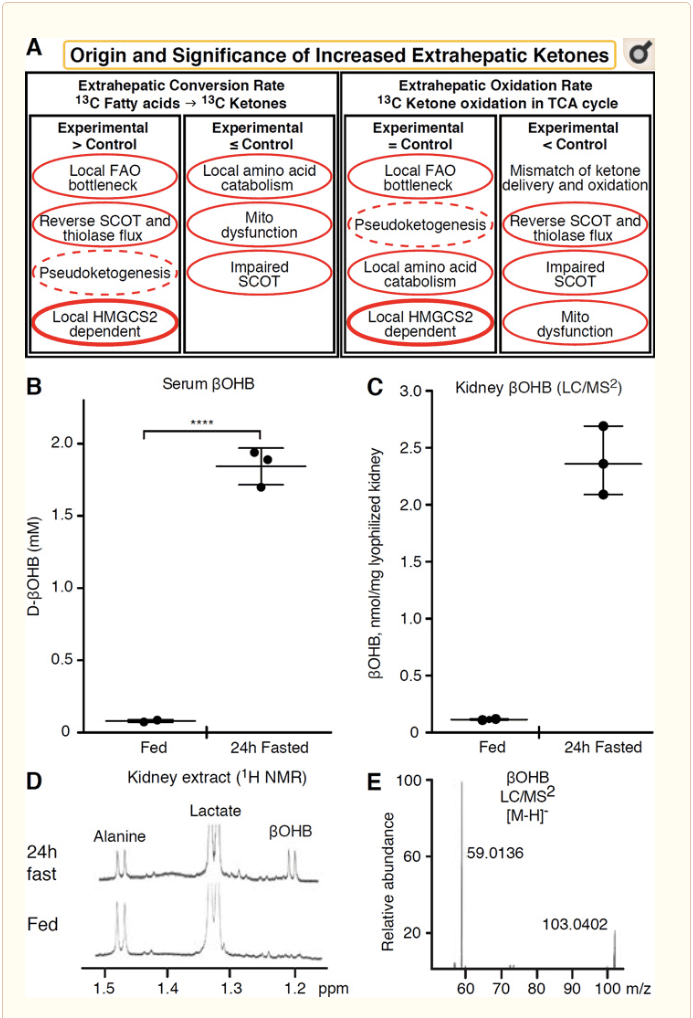

Жақында бүйрекке кетогенді орган ретінде назар аударылды. Мемлекеттердің басым көпшілігінде бүйрек бауырдан алынатын кетон денелерінің таза тұтынушысы болып табылады, кетон денелерін қан ағымынан шығаратын немесе қайта сіңіреді, ал бүйрек әдетте кетон денелерінің таза генераторы немесе концентраторы емес (Робинсон және Уильямсон, 1980). Классикалық зерттеудің авторлары жасанды эксперименттік жүйеде сандық анықталған бүйректің минималды кетогенезі физиологиялық тұрғыдан маңызды емес деген қорытындыға келді (Weidemann and Krebs, 1969). Жақында бүйрек кетогенезі диабеттік және аутофагия тапшылығы бар тінтуірлердің үлгілерінде жасалды, бірақ метаболикалық гомеостаздағы көп мүшелердің ауысуы көптеген органдарға енгізу арқылы интегративті кетон метаболизмін өзгертуі ықтимал (Такаги және басқалар, 2016a; Такаги және т.б., 2016b; Чжан және т.б., 2011). Жақында жарияланған бір басылым бүйректегі кетогенезді бүйректегі ишемия-реперфузиялық зақымданудан қорғайтын механизм ретінде ұсынды (Tran және т.б., 2016). Тышқандардың бүйрек тіндерінің сығындыларынан алынған ?OHB абсолютті тепе-тең концентрациялары ~4�12 мМ деңгейінде хабарланды. Мұның жарамдылығын тексеру үшін біз тамақтандырылған және 24 сағат аш ұстаған тышқандардан алынған бүйрек сығындыларындағы OHB концентрациясын сандық түрде анықтадық. Қан сарысуындағы ?OHB концентрациясы 100 сағаттық аш қарынмен ~2 μM-ден 24 мМ-ге дейін өсті (2В-сурет), ал бүйректегі тепе-теңдік күйдегі ?OHB концентрациясы тамақтанған күйде шамамен 100 μM, ал 1 сағаттық аштық күйінде тек 24 мМ (Cурет ). 2C�E), 45 жыл бұрын мөлшерленген концентрацияларға сәйкес келетін бақылаулар (Хемс және Броснан, 1970). Кетотикалық күйлерде бауырдан алынған кетон денелері ренопротекторлық болуы мүмкін, бірақ бүйрек кетогенезінің дәлелі қосымша негіздеуді қажет етеді. Шынайы бауырдан тыс кетогенезді қолдайтын сенімді дәлелдер RPE-де ұсынылған (Adijanto және басқалар, 2014). Бұл қызықты метаболикалық трансформация RPE-дан алынған кетондардың фоторецепторларға немесе Мюллер глия жасушаларына ағуына мүмкіндік беру үшін ұсынылды, бұл фоторецепторлардың сыртқы сегментінің регенерациясына көмектесуі мүмкін.
?OHB сигналдық делдал ретінде
Олар энергияға бай болғанымен, кетон денелері жасушалық гомеостазда арандатушы «канондық емес» сигналдық рөлдерді орындайды (Cурет 3) (Ньюман және Вердин, 2014; Рохас-Моралес және т.б., 2016). Мысалы, ?OHB гистон ацетилденуін жоғарылататын және осылайша тотығу стрессін азайтатын гендердің экспрессиясын индукциялайтын I класс HDACs тежейді (Simazu және т.б., 2013). ?OHB өзі аш қарынға немесе стрептозотоцинмен индукцияланған диабеттік тышқандардың бауырындағы лизин қалдықтарындағы гистон ковалентті модификаторы болып табылады (Xie және т.б., 2016) (сонымен қатар төменде қараңыз, Кетон денесінің метаболизмінің интеграциясы, трансляциядан кейінгі модификациясы және жасуша физиологиясы және және Кетон денелері, тотығу стрессі және нейропротекция).
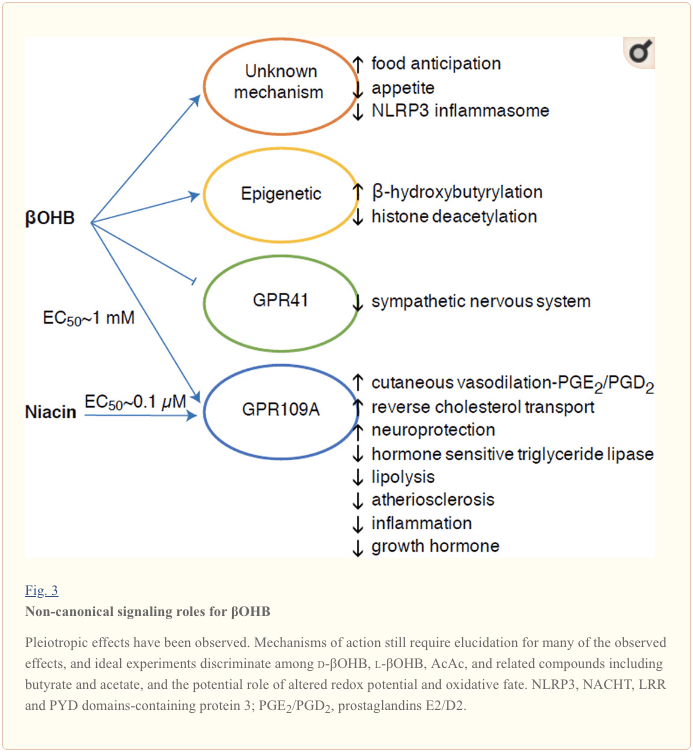
?OHB сонымен қатар G-белокпен байланысқан рецепторлар арқылы эффектор болып табылады. Түсініксіз молекулалық механизмдер арқылы ол симпатикалық жүйке жүйесінің белсенділігін басады және G протеинімен біріктірілген рецептор 41 (GPR41) арқылы қысқа тізбекті май қышқылы сигналын тежеу арқылы жалпы энергия шығыны мен жүрек соғу жиілігін төмендетеді (Кимура және басқалар, 2011). ?OHB-ның ең көп зерттелген сигналдық әсерлерінің бірі май тіндерінде (ақ және қоңыр) экспрессияланған гидрокарбон қышқылы GPCR қосалқы отбасының мүшесі GPR109A (HCAR2 деп те белгілі) арқылы өтеді (Tunaru және басқалар, 2003) және иммундық жасушалар (Ahmed et al., 2009). ?OHB - AcAc емес, d-?OHB, l-?OHB және бутират арқылы белсендірілген GPR109A рецепторының (EC50 ~770 M) жалғыз белгілі эндогендік лиганды (Taggart және т.б., 2005). GPR109A белсендіруінің жоғары концентрация шегіне кетогендік диетаны сақтау, аштық немесе кетоацидоз кезінде қол жеткізіледі, бұл май тінінің липолизін тежеуге әкеледі. GPR109A антилиполитикалық әсері гормонға сезімтал триглицеридті липазаны тежей отырып, аденилилциклазаны тежеу және cAMP төмендеуі арқылы жүреді (Ахмед және басқалар, 2009; Тунару және басқалар, 2003). Бұл теріс кері байланыс циклін жасайды, онда кетоз адипоциттерден этерификацияланбаған май қышқылдарының бөлінуін азайту арқылы кетогенезге модуляциялық тежеу орнатады (Ахмед және басқалар, 2009; Таггарт және басқалар, 2005), бұл әсерді тепе-теңдікпен жоюға болады. липолизді ынталандыратын симпатикалық қозғалтқыш. Ниацин (В3 дәрумені, никотин қышқылы) GRP50A үшін күшті (EC0.1 ~ 109 μM) лиганд болып табылады, дислипидемиялар үшін ондаған жылдар бойы тиімді қолданылады (Benyo және басқалар, 2005; Бенё және басқалар, 2006; Fabbrini және т.б., 2010; Лукасова және т.б., 2011; Тунару және т.б., 2003). Ниацин макрофагтардағы кері холестеринді тасымалдауды күшейтіп, атеросклеротикалық зақымдануларды азайтса (Лукасова және басқалар, 2011), OHB атеросклеротикалық зақымдарға әсері белгісіз болып қалады. GPR109A рецепторы қорғаныс рөлін атқарса да, инсульт пен нейродегенеративті ауруларда кетогендік диетаны қолдану арасында қызықты байланыстар бар болса да (Фу және басқалар, 2015; Рахман және басқалар, 2014), GPR109A арқылы ?OHB қорғаныс рөлі in vivo көрсетілмеген. .
Соңында, ?OHB тәбет пен қанықтылыққа әсер етуі мүмкін. Кетогендік және өте төмен энергия диеталарының әсерін өлшейтін зерттеулердің мета-талдауы осы диеталарды тұтынатын қатысушылар бақылау диеталарымен салыстырғанда жоғары қанықтыруды көрсетеді деген қорытындыға келді (Гибсон және басқалар, 2015). Дегенмен, бұл әсердің ақылға қонымды түсіндірмесі тәбетті өзгерте алатын қосымша метаболикалық немесе гормоналды элементтер болып табылады. Мысалы, кеміргіштердің кетогендік диетасында ұсталған тышқандар, ұқсас калорияларға қарамастан, тышқандармен қоректенетін тышқандармен салыстырғанда энергия шығынының жоғарылауын көрсетті және айналымдағы лептин немесе қоректену тәртібін реттейтін пептидтердің гендері өзгерген жоқ (Кеннеди және басқалар, 2007). ?OHB арқылы тәбетті басуды ұсынатын ұсынылатын механизмдер арасында сигнал беру де, тотығу да кіреді (Laeger et al., 2010). Циркадиандық ырғақ генінің (Per2) гепатоциттерге спецификалық делециясы және хроматинді иммунопреципитациялау зерттеулері PER2 тікелей Cpt1a генін белсендіретінін және Hmgcs2-ні жанама реттейтінін көрсетті, бұл Per2 нокаут тышқандарында кетоздың бұзылуына әкеледі (Чаван және т.б.). Бұл тышқандарда азық-түлікті күту бұзылған, бұл жүйелік ?OHB енгізу арқылы ішінара қалпына келтірілді. Орталық жүйке жүйесін тікелей ?OHB нысанасы ретінде растау үшін болашақ зерттеулер қажет болады және кетон тотығуы байқалған әсерлер үшін қажет пе немесе басқа сигнал беру механизмі қатысады ма. Басқа зерттеушілер тамақ қабылдауды реттеуші ретінде вентромедиальды гипоталамус ішінде жергілікті астроциттерден алынған кетогенез мүмкіндігін шақырды, бірақ бұл алдын ала бақылаулар генетикалық және ағынға негізделген бағалаулардан да пайда көреді (Le Foll және т.б., 2016). Кетоз бен қоректік заттардың жетіспеушілігі арасындағы қарым-қатынас қызығушылық тудырады, өйткені аштық пен қанықтылық салмақ жоғалтудың сәтсіз әрекеттерінің маңызды элементтері болып табылады.
Кетон денесінің метаболизмінің, трансляциядан кейінгі модификациясының және жасуша физиологиясының интеграциясы
Кетон денелері жасушалық метаболизмде маңызды рөл атқаратын негізгі аралық өнім болып табылатын ацетил-КоА-ның бөлінген бассейндеріне ықпал етеді (Pietrocola және т.б., 2015). Ацетил-КоА-ның бір рөлі ацетилдену үшін субстрат ретінде қызмет ету болып табылады, ферментативті катализделген гистон ковалентті модификациясы (Чоудхари және басқалар, 2014; Дутта және басқалар, 2016; Фан және басқалар, 2015; Menzies және басқалар, 2016). ). Көптеген динамикалық ацетилденген митохондриялық ақуыздар, олардың көпшілігі ферментативті емес механизмдер арқылы пайда болуы мүмкін, сонымен қатар есептеу протеомикасының зерттеулерінен пайда болды (Dittenhafer-Reed және басқалар, 2015; Hebert et al., 2013; Rardin және т.б., 2013). ; Шимазу және т.б., 2010). Лизин деацетилазалары цинк кофакторын (мысалы, нуклеоцитозолды HDAC) немесе NAD+ ко-субстрат (сиртуиндер, SIRT) ретінде пайдаланады (Чоудхари және басқалар, 2014; Menzies және т.б., 2016). Ацетилпротеом жалпы жасушалық ацетил-КоА пулының сенсоры және эффекторы ретінде қызмет етеді, өйткені физиологиялық және генетикалық манипуляциялардың әрқайсысы ацетилденудің ферментативті емес жаһандық вариацияларына әкеледі (Weinert және басқалар, 2014). Жасушаішілік метаболиттер лизин қалдығының ацетилденуінің модуляторы ретінде қызмет ететіндіктен, көптігі жоғары динамикалық болатын кетондық денелердің рөлін ескеру қажет.
?OHB кем дегенде екі механизм арқылы эпигенетикалық модификатор болып табылады. Ораза ұстау, калорияларды шектеу, тікелей енгізу немесе ұзақ жаттығулар арқылы туындаған OHB деңгейлерінің жоғарылауы HDAC тежелуін немесе гистон ацетилтрансферазаны белсендіруді (Мароси және басқалар, 2016; Слейман және басқалар, 2016) немесе тотығу стрессін тудырады (Шимазу және басқалар, 2013) . HDAC3 OHB тежелуі жаңа туған нәрестенің метаболикалық физиологиясын реттей алады (Rando және т.б., 2016). Тәуелсіз ?OHB өзі гистон лизинінің қалдықтарын тікелей өзгертеді (Xie et al., 2016). Ұзақ аштық немесе стептозотоцин тудырған диабеттік кетоацидоз гистонның ?-гидроксибутирилденуін күшейтті. Лизиннің ?-гидроксибутирилденуі мен ацетилдену орындарының саны салыстырмалы болғанымен, ацетилденуден гөрі стехиометриялық түрде гистонның ?-гидроксибутирилденуі байқалды. Әртүрлі гендерге гистон лизинінің ?-гидроксибутирилденуі, ацетилденуі немесе метилденуі әсер етті, бұл нақты жасушалық функцияларды көрсетеді. ?-гидроксибутирилденудің өздігінен немесе ферментативті екендігі белгісіз, бірақ кетон денелері арқылы транскрипцияға динамикалық әсер ететін механизмдер ауқымын кеңейтеді.
Калорияны шектеу және қоректік заттардың жетіспеушілігі кезіндегі жасушаларды қайта бағдарламалаудың маңызды оқиғалары SIRT3 және SIRT5-тәуелді митохондриялық деацетилдену және десукцинилдену, бауыр мен бауырдан тыс тіндердегі трансляциядан кейінгі деңгейде кетогендік және кетолитикалық протеиндерді реттейтін делдал болуы мүмкін. 2015; Хеберт және басқалар, 2013; Рардин және басқалар, 2013; Шимазу және басқалар, 2010). Алынған учаскелерді стехиометриялық салыстыру міндетті түрде метаболикалық ағынның ауысуымен тікелей байланысты болмаса да, митохондриялық ацетилдену динамикалық болып табылады және ферментативті ацетилтрансферазалардан гөрі ацетил-КоА концентрациясы немесе митохондриялық рН арқылы басқарылуы мүмкін (Вагнер және Пейн, 2013). SIRT3 және SIRT5 кетондық денені метаболиздендіретін ферменттердің белсенділігін модуляциялауы ацетилпротеомды, сукцинилпротеомды және басқа динамикалық жасушалық нысандарды мүсіндеудегі кетондардың өзара рөлі туралы сұрақты тудырады. Шынында да, кетогенездің вариациялары NAD+ концентрациясын көрсететіндіктен, кетон өндірісі мен көптігі сиртуин белсенділігін реттей алады, осылайша жалпы ацетил-КоА/сукцинил-КоА бассейндеріне, ацилпротеомға және осылайша митохондриялық және жасуша физиологиясына әсер етеді. Лизин ферментінің қалдықтарының ?-гидроксибутирилденуі жасушалық қайта бағдарламалауға тағы бір қабат қосуы мүмкін. Бауырдан тыс тіндерде кетон денесінің тотығуы жасуша гомеостазындағы ұқсас өзгерістерді ынталандыруы мүмкін. Ацетил-КоА бассейндерінің бөлінуі жоғары деңгейде реттеледі және жасушалық өзгерістердің кең спектрін үйлестіреді, ал кетон денелерінің митохондриялық және цитоплазмалық ацетил-КоА концентрацияларын тікелей қалыптастыру қабілеті түсіндіруді қажет етеді (Чен және басқалар, 2012; Корбет және т.б., 2016; Пуговкина және т.б., 2014; Швер және басқалар, 2009; Веллен және Томпсон, 2012). Ацетил-КоА концентрациясы қатаң реттелетіндіктен және ацетил-КоА мембрана өткізбейтін болғандықтан, ацетил-КоА гомеостазын үйлестіретін қозғаушы механизмдерді, соның ішінде TCA цикліндегі өндіріс пен терминалдық тотығу жылдамдығын, кетондық денелерге айналуды, митохондрияны қарастыру өте маңызды. карнитин ацетилтрансфераза (CrAT) арқылы ағып кету немесе цитратқа айналу және ATP цитрат-лиаза (ACLY) арқылы босап шыққаннан кейін ацетил-КоА цитозолға экспорттау. Жасушаның ацетилпротеомындағы және гомеостазындағы осы соңғы механизмдердің негізгі рөлдері кетогенез және кетон тотығу рөлдерін сәйкес түсінуді талап етеді (Das және басқалар, 2015; McDonnell және басқалар, 2016; Moussaieff және т.б., 2015; Овермиер және басқалар., 2015; Seiler және басқалар, 2014; Seiler және басқалар, 2015; Wellen және басқалар, 2009; Wellen and Thompson, 2012). Метаболомика мен ацилпротеомикадағы конвергентті технологиялар, мақсаттар мен нәтижелерді нақтылау үшін генетикалық манипуляцияланған модельдер жағдайында қажет болады.
Кетон денелеріне қарсы және қабынуға қарсы жауаптар
Кетоз және кетон денелері қабынуды және иммундық жасушалардың жұмысын реттейді, бірақ әртүрлі және тіпті сәйкес келмейтін механизмдер ұсынылған. Ұзақ уақыт бойы қоректік заттардың жетіспеушілігі қабынуды азайтады (Youm және басқалар, 2015), бірақ 1 типті қант диабетінің созылмалы кетозы қабынуға қарсы күй болып табылады (Джаин және басқалар, 2002; Каникарла-Мари және Джейн, 2015; Курепа және басқалар, 2012). ). Қабынудағы ?OHB үшін механизмге негізделген сигналдық рөлдер пайда болады, өйткені көптеген иммундық жүйе жасушалары, соның ішінде макрофагтар немесе моноциттер, GPR109A-ны мол экспрессиялайды. ?OHB негізінен қабынуға қарсы жауап береді (Фу және басқалар, 2014; Гамбхир және басқалар, 2012; Рахман және басқалар, 2014; Youm және басқалар, 2015), кетон денелерінің жоғары концентрациясы, әсіресе AcAc, қабынуға қарсы реакцияны тудырады (Джейн және басқалар, 2002; Каникарла-Мари және Джейн, 2015; Курепа және басқалар, 2012).
GPR109A лигандтарының атеросклероз, семіздік, ішектің қабыну аурулары, неврологиялық аурулар және қатерлі ісіктердегі қабынуға қарсы рөлдері қарастырылды (Граф және басқалар, 2016). GPR109A экспрессиясы диабеттік модельдердің RPE жасушаларында, адам диабетімен ауыратын науқастарда (Гамбхир және басқалар, 2012) және нейродегенерация кезінде микроглияда (Фу және басқалар, 2014) күшейтіледі. ?OHB қабынуға қарсы әсерлері RPE жасушаларында GPR109A шамадан тыс экспрессиясы арқылы күшейтіледі және фармакологиялық тежелу немесе GPR109A генетикалық нокаутымен жойылады (Гамбхир және басқалар, 2012). OHB және экзогендік никотин қышқылы (Taggart және т.б., 2005), екеуі де TNF қабынуға қарсы әсер береді? немесе ішінара NF тежеу арқылы қабынуға қарсы ақуыздардың (iNOS, COX-2) немесе бөлінетін цитокиндердің (TNF?, IL-1?, IL-6, CCL2/MCP-1) деңгейін төмендету арқылы LPS-индукцияланған қабыну. -?B транслокациясы (Fu және т.б., 2014; Gambhir et al., 2012). ?OHB антиоксиданттық стресс реакциясын белсендіретін ER стрессін және NLRP3 қабынуын төмендетеді (Bae және басқалар, 2016; Youm және т.б., 2015). Дегенмен, нейродегенеративті қабынуда GPR109A-тәуелді ?OHB-делдалдық қорғаныс MAPK жолының сигнализациясы сияқты қабыну медиаторларын қамтымайды (мысалы, ERK, JNK, p38) (Fu және басқалар, 2014), бірақ COX-1-ге тәуелді PGD2 қажет болуы мүмкін. өндіру (Rahman et al., 2014). GPR109A макрофагының ишемиялық инсульт үлгісінде нейропротекторлық әсер ету үшін қажет екендігі қызық (Рахман және басқалар, 2014), бірақ ?OHB-нің сүйек кемігінен алынған макрофагтардағы NLRP3 қабынуын тежеу қабілеті GPR109A тәуелсіз (Youm және басқалар) ., 2015). Көптеген зерттеулер ?OHB-ны қабынуға қарсы әсерлермен байланыстырғанымен, ?OHB қабынуға қарсы болуы мүмкін және бұзау гепатоциттеріндегі липидтердің асқын тотығуының маркерлерін арттырады (Shi және басқалар, 2014). Осылайша, ?OHB қабынуға қарсы әсерлері жасуша түріне, ?OHB концентрациясына, әсер ету ұзақтығына және ко-модуляторлардың болуына немесе болмауына байланысты болуы мүмкін.
?OHB айырмашылығы, AcAc қабынуға қарсы сигналды белсендіруі мүмкін. Жоғары AcAc, әсіресе глюкозаның жоғары концентрациясы бар, NADPH оксидаза/тотықтырғыш стресске тәуелді механизм арқылы эндотелий жасушаларының зақымдануын күшейтеді (Каникарла-Мари және Джейн, 2015). Қант диабетімен ауыратын аналардың кіндігіндегі жоғары AcAc концентрациясы ақуыздың жоғары тотығу жылдамдығымен және MCP-1 концентрациясымен байланысты болды (Kurepa және басқалар, 2012). Қант диабетімен ауыратын науқастарда жоғары AcAc TNF-мен корреляцияланды ма? экспрессия (Jain және басқалар, 2002) және AcAc, бірақ ?OHB емес, индукцияланған TNF?, MCP-1 экспрессиясы, ROS жинақталуы және U937 адамның моноцит жасушаларында cAMP деңгейінің төмендеуі (Jain және басқалар, 2002; Курепа және т.б.) ., 2012).
Кетон денесіне тәуелді сигналдық құбылыстар көбінесе кетон денелерінің жоғары концентрацияларында (> 5 мМ) және кетондарды про- немесе қабынуға қарсы әсерлермен байланыстыратын көптеген зерттеулер жағдайында түсініксіз механизмдер арқылы іске асады. Сонымен қатар, қабынуға қарсы ?OHB қарсы AcAc қарама-қайшы әсерлеріне және AcAc/?OHB қатынасының митохондриялық тотығу-тотықсыздану потенциалына әсер ету қабілетіне байланысты кетон денелерінің жасушалық фенотиптердегі рөлін бағалайтын ең жақсы эксперименттер AcAc және ? OHB әртүрлі қатынаста және әртүрлі жинақталған концентрацияларда [мысалы, (Saito et al., 2016)]. Соңында, AcAc-ты тек литий тұзы немесе қолданар алдында негізді гидролизді қажет ететін этил эфирі ретінде коммерциялық түрде сатып алуға болады. Литий катионы сигнал беру каскадтарын дербес индукциялайды (Manji және т.б., 1995), ал AcAc анионы тұрақсыз. Соңында, рацемиялық d/l-?OHB қолданатын зерттеулер шатастырылуы мүмкін, өйткені тек d-?OHB стереоизомері AcAc-қа дейін тотыға алады, бірақ d-?OHB және l-?OHB GPR109A арқылы әрбір сигнал бере алады, NLRP3 қабынуын тежей алады, және липогендік субстраттар ретінде қызмет етеді.
Кетон денелері, тотығу стрессі және нейропротекция
Тотығу стрессі әдетте шамадан тыс өндіріске және/немесе жоюдың бұзылуына байланысты ROS шамадан тыс көрсетілген күй ретінде анықталады. Кетон денелерінің антиоксиданттық және тотығу стрессін жеңілдететін рөлдері in vitro және in vivo, әсіресе нейропротекторлық контекстте кеңінен сипатталған. Көптеген нейрондар май қышқылдарынан жоғары энергиялы фосфаттарды тиімді өндірмейтіндіктен, бірақ көмірсулар жетіспегенде кетон денелерін тотықтыратындықтан, кетон денелерінің нейропротекторлық әсері ерекше маңызды (Cahill GF Jr, 2006; Edmond et al., 1987; Yang) және т.б., 1987). Тотығу стресс үлгілерінде BDH1 индукциясы және SCOT басылуы кетон денесінің метаболизмін әртүрлі жасуша сигналдарын, тотығу-тотықсыздану потенциалын немесе метаболикалық талаптарды қолдау үшін қайта бағдарламалауға болатындығын көрсетеді (Nagao және басқалар, 2016; Tieu және басқалар, 2003).
Кетон денелері нейрондар мен кардиомиоциттердегі жасушалық зақымдану, жарақат, өлім және төменгі апоптоздың дәрежесін төмендетеді (Haces және басқалар, 2008; Maalouf және басқалар, 2007; Нагао және басқалар, 2016; Тиеу және басқалар, 2003). Шақырылған механизмдер әртүрлі және әрқашан концентрацияға сызықтық байланысты емес. Төмен миллимолярлық концентрациясы (d немесе l)-?OHB ROS (гидроксил анионын) жояды, ал AcAc көптеген ROS түрлерін жояды, бірақ тек физиологиялық диапазоннан (IC50 20-67 мМ) асатын концентрацияларда (Haces et al., 2008) . Керісінше, электронды тасымалдау тізбегінің тотығу-тотықсыздану потенциалына пайдалы әсер әдетте d-?OHB-мен байланысты механизм болып табылады. Барлық үш кетон денелері (d/l-?OHB және AcAc) нейрондық жасушалардың өлімін және гликолиздің химиялық тежелуінен туындаған ROS жинақталуын азайтса, тек d-?OHB және AcAc нейрондық ATP төмендеуіне жол бермеді. Керісінше, гипогликемиялық in vivo үлгісінде (d немесе l) -?OHB, бірақ AcAc емес, гиппокампальды липидтердің асқын тотығуын болдырмайды (Haces және басқалар, 2008; Maalouf және басқалар, 2007; Мароси және басқалар, 2016; Мерфи, 2009). ; Tieu және т.б., 2003). Кетогендік диетамен (87% ккал май және 13% ақуыз) тамақтандырылған тышқандарды in vivo зерттеулері антиоксиданттық сыйымдылықтың нейроанатомиялық вариациясын көрсетті (Ziegler және басқалар, 2003), мұнда ең терең өзгерістер гиппокампта байқалды, глутатион пероксидазасының және жалпы санының жоғарылауымен. антиоксиданттық қабілеттер.
Кетогендік диета, кетон эфирлері (сонымен қатар кетогендік диетаны және экзогендік кетон денелерін терапевтік қолдануды қараңыз) немесе OHB әкімшілігі ишемиялық инсульт үлгілерінде нейропротекторлық әсер етеді (Рахман және т.б., 2014); Паркинсон ауруы (Tieu және т.б., 2003); орталық жүйке жүйесінің оттегі уыттылығының ұстамасы (D'Agostino және т.б., 2013); эпилептикалық спазмтар (Yum et al., 2015); митохондриялық энцефаломиопатия, лактоацидоз және инсульт тәрізді (MELAS) синдромы (Фрей және басқалар, 2016) және Альцгеймер ауруы (Куннан және Кроуфорд, 2003; Ин және басқалар, 2016). Керісінше, жақында жасалған есеп митохондриялық биогенездің және антиоксиданттық қолтаңбалардың жоғарылауына қарамастан, митохондриялық ДНҚ-ны қалпына келтірудің трансгендік үлгісінде кетогендік диета арқылы нейродегенеративті прогрессияның гистологиялық дәлелдерін көрсетті (Lauritzen et al., 2016). Басқа қарама-қайшы есептер кетон денесінің жоғары концентрациясының әсері тотығу стрессін тудырады деп болжайды. Жоғары ?OHB немесе AcAc дозалары азот оксидінің секрециясын, липидтердің асқын тотығуын, бұзау гепатоциттерінде SOD, глутатионпероксидаза және каталаза экспрессиясының төмендеуін туғызды, ал егеуқұйрық гепатоциттерінде MAPK жолының индукциясы AcAc-ке жатқызылды, бірақ ?OHB емес (Abdelmegeed et al.2004, ; Shi et al., 2014; Shi et al., 2016).
Біріктірілген есептердің көпшілігі ?OHB-ны тотығу стрессінің әлсіреуімен байланыстырады, өйткені оны қолдану ROS/супероксид өндірісін тежейді, липидтердің асқын тотығуы мен ақуыздың тотығуын болдырмайды, антиоксиданттық ақуыз деңгейін жоғарылатады және митохондриялық тыныс алу мен ATP өндірісін жақсартады (Abdelmegeed et al., 2004; Haces және т.б., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Maalouf et al., 2007; Maalouf and Rho, 2008; Marosi et al., 2016;eu және т.б., 2003; Yin және басқалар, 2016; Ziegler және т.б., 2003). AcAc тотығу стресінің индукциясымен OHB-ге қарағанда тікелей байланысты болғанымен, бұл әсерлер әрқашан қабынуға қарсы болжамды жауаптардан оңай бөлінбейді (Джаин және басқалар, 2002; Каникарла-Мари және Джейн, 2015; Каникарла-Мари және Джейн, 2016). Сонымен қатар, плейотропты кетогендік диеталар беретін айқын антиоксиданттық артықшылықты кетондық денелердің өзі өзгертпеуі мүмкін екенін және кетон денелері беретін нейропротекторлық тотығу стрессіне толығымен қатысты болмауы мүмкін екенін ескеру өте маңызды. Мысалы, глюкоза тапшылығы кезінде, кортикальды нейрондардағы глюкоза жетіспеушілігінің үлгісінде ?OHB аутофагиялық ағынды ынталандырды және нейрондық өлімнің төмендеуімен байланысты аутофагосоманың жиналуын болдырмайды (Camberos-Luna және т.б., 2016). d-?OHB сонымен қатар HDAC тежеу арқылы FOXO3a, SOD, MnSOD және каталазаның канондық антиоксидант протеиндерін индукциялайды (Нагао және басқалар, 2016; Шимазу және басқалар, 2013).
Алкогольді емес майлы бауыр ауруы (NAFLD) және кетондық дененің метаболизмі
Семіздікке байланысты NAFLD және алкогольсіз стеатогепатит (NASH) Батыс елдерінде бауыр ауруларының ең көп тараған себептері болып табылады (Rinella және Sanyal, 2016) және NASH тудырған бауыр жеткіліксіздігі бауыр трансплантациясының ең көп таралған себептерінің бірі болып табылады. Триацилглицериндердің гепатоциттерде бауыр салмағының 5%-дан артық сақталуының өзі бауырдың дегенеративті функциясын тудырмайтынымен, адамдарда NAFLD прогрессиясы жүйелі инсулинге төзімділікпен және 2 типті қант диабеті қаупінің жоғарылауымен сәйкес келеді және патогенезіне ықпал етуі мүмкін. жүрек-тамыр аурулары және созылмалы бүйрек ауруы (Фаббрини және басқалар, 2009; Таргер және басқалар, 2010; Таргер және Бирн, 2013). NAFLD және NASH патогендік механизмдері толық түсінілмейді, бірақ гепатоциттердің метаболизмінің ауытқулары, гепатоциттердің аутофагиясы және эндоплазмалық ретикулум стрессі, бауырдың иммундық жасушаларының қызметі, май тінінің қабынуы және жүйелі қабыну медиаторлары (Fabbrinioka et al. Таргер және т.б., 2009; Янг және т.б., 2013). Көмірсулар, липидтер және аминқышқылдары алмасуының бұзылуы адамдарда және модельдік организмдерде семіздік, қант диабеті және NAFLD кезінде пайда болады және оған ықпал етеді [қаралған (Farese және т.б., 2010; Lin және Accili, 2010; Newgard, 2012; Samuel және Шульман, 2011; Sun and Lazar, 2012)]. Цитоплазмалық липидтер алмасуындағы гепатоциттердің ауытқулары әдетте NAFLD-да байқалғанымен (Fabbrini және т. Митохондриялық метаболизмнің ауытқулары NAFLD/NASH патогенезінде орын алады және оған ықпал етеді (Hyotylainen және басқалар, 2012; Serviddio және басқалар, 2013; Serviddio және басқалар, 2010; Wei және басқалар, 2016). Жалпы (Felig et al., 2011; Iozzo et al., 2008; Koliaki et al., 2008; Satapati et al., 1974; Satapati et al., 2010; Sunny et al., 2015), бірақ біркелкі емес ( Колиаки және Роден, 2015; Перри және басқалар, 2012; Ректор және басқалар, 2011) адал NASH дамығанға дейін бауырдың митохондриялық тотығуы, әсіресе майдың тотығуы семіздікте, жүйелі инсулинге төзімділікте артады деген консенсус. , және NAFLD. NAFLD дамып келе жатқанда, тіпті жеке митохондриялар арасында тотығу қабілетінің гетерогенділігі пайда болуы мүмкін және сайып келгенде тотығу функциясы бұзылады (Koliaki және басқалар, 2013; Ректор және басқалар, 2016; Сатапати және басқалар, 2010; Сатапати және басқалар. ., 2015).
Кетогенез көбінесе бауыр майының тотығуы үшін прокси ретінде пайдаланылады. Кетогенездің бұзылуы жануарлар үлгілерінде және адамдарда, мүмкін, NAFLD прогреске байланысты пайда болады. Толық анықталмаған механизмдер арқылы гиперинсулинемия кетогенезді басады, бұл арық бақылаумен салыстырғанда гипокетонемияға ықпал етуі мүмкін (Бергман және басқалар, 2007; Бикертон және басқалар, 2008; Сатапати және т.б., 2012; Soeters және т.б., 2009; , 2011; Вице және т.б., 2005). Осыған қарамастан, айналымдағы кетон денесінің концентрациясының NAFLD болжау мүмкіндігі даулы болып табылады (M nnist et al., 2015; Sanyal et al., 2001). Жануарлар үлгілеріндегі сенімді сандық магниттік-резонанстық спектроскопиялық әдістер инсулинге төзімділігі орташа кетондық айналым жылдамдығының жоғарылауын анықтады, бірақ инсулинге төзімділіктің жоғарылауымен төмендеу жылдамдығы айқын болды (Сатапати және басқалар, 2012; Sunny және т.б., 2010). Майлы бауыры бар семіз адамдарда кетогендік жылдамдық қалыпты (Бикертон және басқалар, 2008; Sunny және т.б., 2011), демек, кетогенез жылдамдығы гепатоциттердегі май қышқылының жоғарылауына қатысты төмендейді. Демек, ?-тотығудан алынған ацетил-КоА TCA цикліндегі терминалдық тотығуға бағытталуы мүмкін, терминалдық тотығуды, анаплероз/катаплероз арқылы фосфоэнолпируватпен басқарылатын глюконеогенезді және тотығу стрессін арттырады. Ацетил-КоА сонымен қатар митохондриялардан цитрат, липогенездің прекурсорлық субстраты ретінде экспортталуы мүмкін (4-сурет) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Кетогенез инсулинге немесе ұзақ семіздікпен аштыққа азырақ жауап беретін болса да (Сатапати және т.б., 2012), мұның негізгі механизмдері мен төменгі ағынының салдары әлі толық түсінілмеген. Соңғы дәлелдер mTORC1 кетогенезді инсулин сигнализациясының төменгі ағынында болуы мүмкін жолмен басатынын көрсетеді (Кучежова және т.б., 2016), бұл mTORC1 PPAR?-делдалдық Hmgcs2 индукциясын тежейтін бақылауларға сәйкес келеді (Sengupta және басқалар, 2010) сондай-ақ HMGCS2 және SCOT/OXCT1 ережелерін қараңыз).

Біздің топтың алдын ала бақылаулары кетогендік жеткіліксіздіктің жағымсыз бауыр салдарын болжайды (Cotter et al., 2014). Кетогенездің бұзылуы, тіпті көмірсуларға толы және осылайша «кетогенді емес» күйлерде де глюкозаның қалыпсыз метаболизміне ықпал етеді және стеатогепатитті қоздырады деген гипотезаны тексеру үшін біз мақсатқа бағытталған антисенс олигонуклеотидтерін (ASO) енгізу арқылы айқын кетогендік жеткіліксіздіктің тінтуір үлгісін жасадық. Hmgcs2. Стандартты майы аз шошқа тамақтандыратын ересек тышқандарда HMGCS2 жоғалуы жеңіл гипергликемияны тудырды және бауырдың жүздеген метаболиттерінің өндірісін айтарлықтай арттырды, олардың жиынтығы липогенездің белсендірілуін айқын көрсетті. Кетогенезі жеткіліксіз тышқандарды жоғары майлы диетамен тамақтандыру гепатоциттердің кең зақымдануына және қабынуына әкелді. Бұл тұжырымдар (i) кетогенез пассивті толып кету жолы емес, керісінше бауыр және біріктірілген физиологиялық гомеостаздағы динамикалық түйін және (ii) NAFLD/NASH және бауыр глюкозасының бұзылған метаболизмін жеңілдету үшін абайлап кетогенді күшейту зерттеуге лайық деген орталық гипотезаларды қолдайды. .
Кетогенездің бұзылуы бауырдың зақымдалуына және глюкоза гомеостазының өзгеруіне қалай ықпал етуі мүмкін? Бірінші мәселе - кінәлі кетогендік ағынның жетіспеушілігі немесе кетондардың өздері. Жақында жасалған есеп кетон денелері n-3 полиқанықпаған май қышқылдарына жауап ретінде тотығу стрессінен туындаған бауыр жарақатын жеңілдетуі мүмкін деп болжайды (Павлак және т.б., 2015). Естеріңізге сала кетейік, гепатоциттерде SCOT экспрессиясының болмауына байланысты кетон денелері тотықпайды, бірақ олар липогенезге ықпал ете алады және олардың тотығуына тәуелсіз әртүрлі сигналдық рөлдерді атқара алады (сонымен бірге кетон денелерінің тотығусыз метаболикалық тағдырларын және ?OHB ретінде қараңыз). сигналдық медиатор). Сондай-ақ, гепатоциттерден алынған кетон денелері бауыр ацинусындағы көрші жасушалар түрлері, соның ішінде жұлдыз тәрізді жасушалар мен Купфер жасушаларының макрофагтары үшін сигнал және/немесе метаболит ретінде қызмет етуі мүмкін. Шектеулі әдебиеттер макрофагтардың кетон денелерін тотықтыруға қабілетсіз екенін көрсетеді, бірақ бұл тек классикалық әдістемелер арқылы және тек перитонеальді макрофагтарда ғана өлшенген (Newsholme және т. сүйек кемігінен алынған макрофагтардағы SCOT экспрессиясының мол болуын ескере отырып, бағалау орынды (Youm et al., 1986).
Гепатоциттердің кетогендік ағыны да цитопротекторлық болуы мүмкін. Пайдалы механизмдер кетогенезге тәуелді болмаса да, төмен көмірсутекті кетогендік диеталар NAFLD жақсартуымен байланысты болды (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar and Crawford, 2012) . Біздің бақылауларымыз гепатоциттердің кетогенезі TCA циклінің ағынын, анаплеротикалық ағынды, фосфоэнолпируваттан алынған глюконеогенезді (Cotter және басқалар, 2014) және тіпті гликоген айналымын кері байланыстыруы және реттеуі мүмкін екенін көрсетеді. Кетогендік бұзылу ацетил-КоА-ны TCA ағынының жоғарылауына бағыттайды, бұл бауырда ROS-делдалдық жарақаттың жоғарылауымен байланысты (Сатапати және басқалар, 2015; Сатапати және басқалар, 2012); көміртекті цитотоксикалық дәлелдейтін жаңа синтезделген липидтік түрлерге бұруға мәжбүр етеді; және NADH қайта NAD+ тотығуын болдырмайды (Cotter және т.б., 2014) (Cурет 4). Бірге алғанда, салыстырмалы кетогендік жеткіліксіздіктің бейімсіз болуы, гипергликемияға ықпал етуі, стеатогепатитті қоздыруы және бұл механизмдердің адамның NAFLD/NASH-те жұмыс істейтін-болмауы мүмкін механизмдерді шешу үшін болашақ эксперименттер қажет. Эпидемиологиялық дәлелдемелер стеатогепатиттің дамуы кезінде кетогенездің бұзылғанын көрсетеді (Эмбаде және басқалар, 2016; Мариноу және басқалар, 2011; M�nnist� және басқалар, 2015; Прамфалк және басқалар, 2015; Сафаеи және басқалар, 2016) Бауыр кетогенезін арттыратын терапия пайдалы болуы мүмкін (Degirolamo және басқалар, 2016; Хонда және басқалар, 2016).
Кетон денелері және жүрек жеткіліксіздігі (HF)
Метаболизм жылдамдығы тәулігіне 400 ккал/кг асатын және айналымы 6-35 кг АТФ/тәулігіне, жүрек ең жоғары энергия шығыны мен тотығу сұранысы бар орган болып табылады (Ashrafian және басқалар, 2007; Ванг және т.б., 2010b). Миокард энергия айналымының басым көпшілігі митохондрияларда болады және бұл қамтамасыз етудің 70% ФАО-дан келеді. Жүрек қалыпты жағдайда қоректік және икемді, бірақ патологиялық қайта құрылатын жүрек (мысалы, гипертония немесе миокард инфарктісі салдарынан) және диабеттік жүректің әрқайсысы метаболикалық икемді емес болады (Balasse және Fery, 1989; BING, 1954; Fukao et al., 2004). ; Lopaschuk және т.б., 2010; Taegtmeyer және басқалар, 1980; Taegtmeyer және басқалар, 2002; Young және басқалар, 2002). Шынында да, тінтуір үлгілеріндегі жүрек отын алмасуының генетикалық бағдарламаланған ауытқулары кардиомиопатияны тудырады (Карли және басқалар, 2014; Neubauer, 2007). Физиологиялық жағдайларда қалыпты жүректер кетон денелерін май қышқылы мен глюкозаның тотығуы есебінен олардың жеткізілуіне пропорционалды тотықтырады, ал миокард масса бірлігіне келетін ең жоғары кетон денелерінің тұтынушысы болып табылады (BING, 1954; Кроуфорд және басқалар, 2009; GARLAND және т.б. ., 1962; Hasselbaink және т.б., 2003; Джеффри және басқалар, 1995; Pelletier және т.б., 2007; Тардиф және басқалар, 2001; Ян және басқалар, 2009). Май қышқылдарының тотығуымен салыстырғанда кетон денелері энергиялық жағынан тиімдірек, жұмсалған оттегінің бір молекуласына АТФ синтезі үшін көбірек энергия береді (P/O қатынасы) (Кашивая және басқалар, 2010; Сато және т.б., 1995; Veech, 2004) . Кетон денесінің тотығуы сонымен қатар ФАО-ға қарағанда ықтимал жоғары энергия береді, бұл убихинонның тотығуын сақтайды, бұл электрондарды тасымалдау тізбегіндегі тотығу-тотықсыздану аралығын арттырады және ATP синтезіне көбірек энергия береді (Сато және т.б., 1995; Veech, 2004). Кетон денелерінің тотығуы сонымен қатар ROS өндірісін және осылайша тотығу стрессін азайтуы мүмкін (Veech, 2004).
Алдын ала интервенциялық және бақылаулық зерттеулер жүректегі кетондық денелердің әлеуетті пайдалы рөлін көрсетеді. Эксперименттік ишемия/реперфузиялық жарақат контекстінде кетон денелері жүректегі митохондриялық молшылықтың жоғарылауына немесе маңызды тотығу фосфорлануының жоғарылауына байланысты ықтимал кардиопротекторлық әсерлер берді (Al-Zaid және басқалар, 2007; Ванг және басқалар, 2008). медиаторлар (Snorek et al., 2012; Zou et al., 2002). Соңғы зерттеулер тышқандардың (Aubert және басқалар, 2016) және адамдардың (Bedi және т.б., 2016) бұзылған жүректерінде кетон денесін пайдаланудың жоғарылағанын көрсетеді, бұл адамдардағы бұрынғы бақылауларды (BING, 1954; Fukao және т.б., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph and Schinz, 1973; Tildon and Cornblath, 1972). Айналымдағы кетон денесінің концентрациясы жүрек жеткіліксіздігі бар науқастарда толтыру қысымына, механизмі мен маңызы белгісіз болып қалатын бақылауларға тікелей пропорционалды түрде артады (Купари және басқалар, 1995; Ломми және басқалар, 1996; Ломми және басқалар, 1997; Нели және басқалар. ., 1972), бірақ кардиомиоциттерде селективті SCOT тапшылығы бар тышқандар хирургиялық индукцияланған қысымды шамадан тыс жүктеме жарақатына жауап ретінде жеделдетілген патологиялық қарыншалық қайта құруды және ROS белгілерін көрсетеді (Schugar және басқалар, 2014).
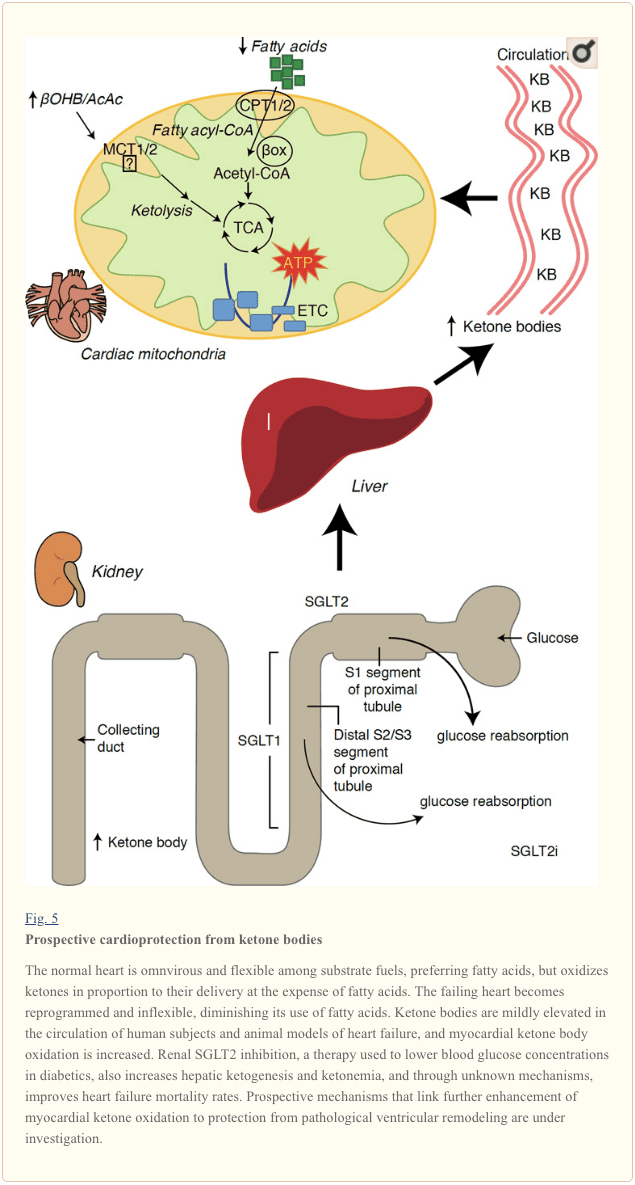
Қант диабетін емдеудегі соңғы қызықты бақылаулар миокардтың кетондық метаболизмі мен патологиялық қарыншаның қайта құрылуы арасындағы ықтимал байланысты анықтады (Cурет 5). Бүйрек проксимальды түтікшелі натрий/глюкоза ко-тасымалдаушысының 2 (SGLT2i) тежелуі адамдарда (Ferrannini және басқалар, 2016a; Inagaki және басқалар, 2015) және тышқандардағы (Сузуки және басқалар, 2014) айналымдағы кетон денесінің концентрациясын жоғарылатады. бауыр кетогенезі (Ferrannini және басқалар, 2014; Ferrannini және басқалар, 2016a; Katz және Leiter, 2015; Mudaliar және басқалар, 2015). Бір қызығы, осы агенттердің кем дегенде біреуі ЖЖ ауруханаға жатқызуды азайтты (мысалы, EMPA-REG OUTCOME сынағы көрсеткендей) және жүрек-қан тамырлары өлімін жақсартты (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a). ; Зинман және т.б., 2015). Байланысты SGLT2i-ге пайдалы HF нәтижелерінің артында тұрған драйвер механизмдері белсенді түрде талқылануда, өмір сүрудің пайдасы көп факторлы болуы мүмкін, перспективалық түрде кетозды қосады, сонымен қатар салмаққа, қан қысымына, глюкоза мен зәр қышқылы деңгейіне, артериялық қаттылыққа, симпатикалық жүйке жүйесіне, осмотикалық әсерге пайдалы әсер етеді. диурез / плазма көлемінің төмендеуі және гематокриттің жоғарылауы (Raz және Cahn, 2016; Vallon and Thomson, 2016). Бірге алғанда, ЖЖ пациенттерінде немесе ЖЖ даму қаупі жоғары науқастарда кетонемияны терапевтік ұлғайту туралы түсінік даулы болып қала береді, бірақ клиникаға дейінгі және клиникалық зерттеулерде белсенді түрде зерттелуде (Ferrannini және басқалар, 2016b; Kolwicz және т.б., 2016; Лопащук және Верма, 2016; Мудалиар және т.б., 2016; Taegtmeyer, 2016).
Қатерлі ісік биологиясындағы кетондық денелер
Кетон денелері мен қатерлі ісік арасындағы байланыстар тез дамып келеді, бірақ жануарлар үлгілерінде де, адамдарда да зерттеулер әртүрлі қорытындылар берді. Кетон метаболизмі динамикалық және қоректік күйге жауап беретіндіктен, дәлдікпен басқарылатын тамақтану терапиясының әлеуеті болғандықтан, қатерлі ісікке биологиялық байланыстарды іздеуді қызықтырады. Қатерлі ісік жасушалары жасушалардың жылдам көбеюін және өсуін сақтау үшін метаболикалық қайта бағдарламалаудан өтеді (DeNicola және Cantley, 2015; Павлова және Томпсон, 2016). Қатерлі ісік жасушаларының метаболизміндегі классикалық Варбург әсері энергияны тасымалдау және тотығу фосфорлануына және шектеулі митохондриялық тыныс алуға төмен тәуелділікті өтеу үшін гликолиз және сүт қышқылы ашытуының басым рөлінен туындайды (De Feyter және басқалар, 2016; Grabacka және т.б., 2016; Канг және басқалар, 2015; Пофф және басқалар, 2014; Шукла және басқалар, 2014). Глюкоза көміртегі негізінен ісік биомассасының кеңеюіне қажетті аралық өнімдерді қамтамасыз ететін гликолиз, пентозофосфат жолы және липогенез арқылы бағытталады (Грабека және басқалар, 2016; Шукла және басқалар, 2014; Йошии және басқалар, 2015). Рак жасушаларының глюкозаның жетіспеушілігіне бейімделуі ацетатты, глутаминді және аспартатты қоса алғанда, балама отын көздерін пайдалану мүмкіндігі арқылы жүзеге асады (Джаворски және басқалар, 2016; Салливан және басқалар, 2015). Мысалы, пируватқа шектеулі қолжетімділік рак клеткаларының энергетикалық және анаболикалық қажеттіліктерді сақтай отырып, карбоксилдену арқылы глутаминді ацетил-КоА-ға айналдыру қабілетін көрсетеді (Янг және басқалар, 2014). Рак жасушаларының қызықты бейімделуі ацетатты отын ретінде пайдалану болып табылады (Comerford және басқалар, 2014; Jaworski және т. Ацетат сонымен қатар ісік жасушаларының пролиферациясы үшін маңызды болып табылатын липогенездің субстраты болып табылады және бұл липогендік өткізгіштің пайда болуы пациенттің қысқа өмір сүруімен және ісік жүктемесінің жоғарылауымен байланысты (Comerford және басқалар, 2016; Mashimo және басқалар, 2014; Йошии және басқалар. ., 2016).
Глюкоза жетіспеушілігі кезінде ісік емес жасушалар энергия көзін глюкозадан кетон денелеріне оңай ауыстырады. Бұл икемділік рак клеткаларының түрлері арасында өзгермелі болуы мүмкін, бірақ in vivo имплантацияланған ми ісіктері [2,4-13C2] -?OHB қоршаған ми тініне ұқсас дәрежеде тотығады (De Feyter және т.б., 2016). «Кері Варбург эффектісі» немесе «екі бөлімді ісік метаболизмі» модельдері рак клеткалары ісік жасушаларының энергия қажеттілігін қамтамасыз ететін іргелес фибробласттарда OHB өндірісін индукциялайды деп болжайды (Бонучелли және басқалар, 2010; Мартинез-Оутшоорн және т.б., 2012) . Бауырда гепатоциттердің кетогенезден кетон тотығуына ауысуы гепатоцеллюлярлық карцинома (гепатома) жасушаларында BDH1 және SCOT белсенділігінің екі гепатома жасушаларында байқалған белсендірілуіне сәйкес келеді (Чжан және басқалар, 1989). Шынында да, гепатома жасушалары OXCT1 және BDH1-ді экспрессиялайды және кетондарды тотықтырады, бірақ сарысу аштықта ғана (Хуанг және басқалар, 2016). Сонымен қатар, ісік жасушаларының кетогенезі де ұсынылды. Кетогендік ген экспрессиясының динамикалық ығысулары тоқ ішек эпителийінің қатерлі трансформациясы кезінде көрінеді, әдетте HMGCS2-ні білдіретін жасуша түрі және жақында жасалған есепте HMGCS2 колоректальды және жалпақ жасушалы карциномаларда нашар болжамның болжамдық маркері болуы мүмкін деп болжайды (Камареро және т.б. 2006; Чен және т.б., 2016). Бұл қауымдастық кетогенезді немесе HMGCS2 айдың жарықтандыру функциясын қажет ете ме немесе қоса ма, әлі анықталу керек. Керісінше, PPAR арқылы ынталандырылған меланома және глиобластома жасушаларының айқын ?OHB өндірісі? агонист фенофибрат өсудің тоқтауымен байланысты болды (Grabacka және т.б., 2016). Рак жасушаларында HMGCS2/SCOT экспрессиясының, кетогенездің және кетон тотығуының рөлдерін сипаттау үшін қосымша зерттеулер қажет.
Жақында кетондар отын алмасуынан тыс, сигнал беру механизмі арқылы рак клеткаларының биологиясына қатысты. BRAF-V600E+ меланомасының талдауы онкогенді BRAF-тәуелді түрде HMGCL-нің OCT1-тәуелді индукциясын көрсетті (Канг және т.б., 2015). HMGCL ұлғаюы жоғары жасушалық AcAc концентрациясымен корреляцияланды, бұл өз кезегінде BRAFV600E-MEK1 өзара әрекеттесуін жақсартты, ісік жасушаларының пролиферациясы мен өсуін басқаратын алға жіберу циклінде MEK-ERK сигналын күшейтті. Бұл бақылаулар кейіннен сигнал беру механизмін қолдайтын перспективалық бауырдан тыс кетогенез туралы қызықты сұрақты тудырады (сонымен бірге ?OHB сигналдық медиатор ретінде және бауырдан тыс кетогенездегі қайшылықтарды қараңыз). Сондай-ақ AcAc, d-?OHB және l-?OHB қатерлі ісік метаболизміне тәуелсіз әсерлерін ескеру маңызды және HMGCL қарастырғанда, лейцин катаболизмі де бұзылуы мүмкін.
Кетогендік диеталардың әсері (сонымен қатар кетогендік диетаны және экзогендік кетон денелерін терапевтік қолдануды қараңыз) қатерлі ісік жануарларының үлгілерінде әртүрлі (De Feyter және басқалар, 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Сейфрид және басқалар, 2011; Шукла және т.б., 2014). Семіздік, қатерлі ісік және кетогендік диеталар арасындағы эпидемиологиялық байланыстар талқыланып жатқанымен (Liskiewicz және т. Кетоздың шамасына, диетаны бастау уақытына және ісіктің орналасуына перспективалық байланысты пайдалар (Клемент және басқалар, 2016; Вулф және басқалар, 2016). Ұйқы безінің қатерлі ісігі жасушаларын кетон денелерімен (d-?OHB немесе AcAc) емдеу өсуді, пролиферацияны және гликолизді тежейді, ал кетогендік диета (2016% ккал май, 2016% ақуыз, 81% көмірсу) in vivo ісік салмағын, гликемияны және имплантацияланған қатерлі ісігі бар жануарларда бұлшықет пен дене салмағының жоғарылауы (Шукла және т.б., 18). Ұқсас нәтижелер диетада кетон қоспасын алған тышқандарда метастатикалық глиобластома жасушасының үлгісін қолдану арқылы байқалды (Poff және т.б., 1). Керісінше, кетогендік диета (2014% ккал май, 2014% ақуыз) айналымдағы OHB концентрациясын арттырып, гликемияны төмендетті, бірақ ісік көлеміне де, глиомасы бар егеуқұйрықтарда өмір сүру ұзақтығына да әсер еткен жоқ (De Feyter және т.б., 91). Глюкоза кетон индексі адамдар мен тышқандардағы кетогендік диетадан туындаған ми ісігі терапиясының метаболикалық басқаруын жақсартатын клиникалық көрсеткіш ретінде ұсынылды (Мейденбауэр және басқалар, 9). Қатерлі ісік биологиясындағы кетондық дененің метаболизмі мен кетон денелерінің рөлдерін біріктіретін болсақ, олардың әрқайсысының емдік нұсқалары бар, бірақ іргелі аспектілер айнымалы матрицадан, соның ішінде (i) экзогендік кетон арасындағы айырмашылықтардан туындайтын айқын әсерлермен әлі де анықталуы керек. денелер кетогендік диетаға қарсы, (ii) рак клеткаларының түрі, геномдық полиморфизмдер, дәрежесі және сатысы; және (iii) кетотикалық күйге әсер ету уақыты мен ұзақтығы.

Кетогенезді кетон денелері май қышқылдары мен кетогендік аминқышқылдарының ыдырауы арқылы жасайды. Бұл биохимиялық процесс қандағы глюкозаның болмауына жауап ретінде ораза жағдайында әртүрлі органдарды, атап айтқанда миды энергиямен қамтамасыз етеді. Кетон денелері негізінен бауыр жасушаларының митохондрияларында түзіледі. Басқа жасушалар кетогенезді жүзеге асыруға қабілетті болғанымен, олар бауыр жасушалары сияқты тиімді емес. Кетогенез митохондрияда жүретіндіктен, оның процестері дербес реттеледі. Доктор Алекс Хименес DC, CCST Insight
Кетогендік диетаны және экзогендік кетондық денелерді терапевтік қолдану
Кетогендік диеталар мен кетон денелерін терапиялық құралдар ретінде қолдану семіздік пен NAFLD/NASH сияқты қатерлі емес контексттерде де пайда болды (Браунинг және басқалар, 2011; Фостер және басқалар, 2010; Шугар және Кроуфорд, 2012); жүрек жеткіліксіздігі (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); неврологиялық және нейродегенеративті ауру (Мартин және басқалар, 2016; McNally және Hartman, 2012; Rho, 2015; Rogawski және т.б., 2016; Янг және Ченг, 2010; Yao және т.б., 2011); метаболизмнің туа біткен қателері (Scholl-B rgi және басқалар, 2015); және жаттығу өнімділігі (Cox et al., 2016). Кетогенді диеталардың тиімділігі эпилепсиялық ұстамаларды емдеуде, әсіресе дәріге төзімді емделушілерде ерекше бағаланды. Көптеген зерттеулер педиатриялық пациенттердегі кетогендік диеталарды бағалады және 50 айдан кейін ұстама жиілігінің ~ 3% -ға дейін төмендеуін анықтады, бұл таңдалған синдромдарда тиімділігі жоғарылайды (Wu және басқалар, 2016b). Тәжірибе ересектердегі эпилепсияда шектеулі, бірақ ұқсас төмендеу симптоматикалық жалпыланған эпилепсиямен ауыратын науқастарда жақсырақ жауап береді (Nei және басқалар, 2014). Құрысуларға қарсы негізгі механизмдер түсініксіз болып қала береді, дегенмен болжамды гипотезаларға глюкозаны пайдаланудың/гликолиздің төмендеуі, қайта бағдарламаланған глутамат тасымалдауы, ATP-сезімтал калий арнасына немесе аденозин A1 рецепторларына жанама әсер ету, натрий өзекшесінің изоформасының экспрессиясының өзгеруі немесе айналымдағы гормондарға әсер етуі жатады. Ламбрехт және басқалар, 2016; Лин және басқалар, 2017; Лутас және Йеллен, 2013). Антиконвульсант әсері негізінен кетон денелеріне байланысты ма, әлде көмірсулары аз диеталардың каскадты метаболикалық салдарына байланысты ма, белгісіз. Дегенмен, кетон эфирлері (төменде қараңыз) қоздырылған ұстамалардың жануарлар үлгілерінде ұстама шегін жоғарылататын сияқты (Ciarlone және басқалар, 2016; D'Agostino және т.б., 2013; Viggiano және т.б., 2015).
Аткинс стиліндегі және кетогенді, төмен көмірсутекті диеталар жиі жағымсыз болып саналады және іш қатуды, гиперурикемияны, гипокальциемияны, гипомагниемияны тудыруы, нефролитиазға, кетоацидозға әкелуі мүмкін, гипергликемияны тудыруы және айналымдағы холестерин мен бос май қышқылдарының концентрациясын жоғарылатуы мүмкін (Biss2001, s. ; Kossoff және Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Осы себептерге байланысты ұзақ мерзімді ұстану қиындықтар тудырады. Кеміргіштерді зерттеуде әдетте күшті кетозды қоздыратын макронутриенттердің ерекше таралуы (94% ккал май, 1% ккал көмірсу, 5% ккал ақуыз, Bio-Serv F3666) қолданылады. Дегенмен, ақуыздың мазмұнын тіпті 10% ккал дейін арттыру кетозды айтарлықтай төмендетеді, ал 5% ккал ақуызды шектеу шатастыратын метаболикалық және физиологиялық әсерлер береді. Бұл диеталық формулада холин азаяды, бауырдың зақымдалуына және тіпті кетогенезге әсер ететін басқа айнымалы (Гарбоу және басқалар, 2011; Джорнайваз және басқалар, 2010; Кеннеди және басқалар, 2007; Писсиос және басқалар, 2013; Шугар және т.б., 2013). Тышқандардағы кетогендік диеталарды ұзақ уақыт тұтынудың әсері әлі толық анықталмаған, бірақ тышқандардағы соңғы зерттеулер аминқышқылдарының метаболизмі, энергия шығыны және инсулин сигнализациясы болғанымен, олардың өмір сүру ұзақтығы бойынша кетогендік диеталардағы тышқандардың қалыпты өмір сүруін және бауыр зақымдану маркерлерінің жоқтығын көрсетті. айтарлықтай қайта бағдарламаланды (Douris et al., 2015).
Кетогендік диеталарға балама механизмдер арқылы кетозды арттыратын механизмдерге кетон денесінің жұтылатын прекурсорларын пайдалану кіреді. Экзогендік кетон денелерін енгізу қалыпты физиологияда кездеспейтін бірегей физиологиялық жағдайды тудыруы мүмкін, өйткені айналымдағы глюкоза мен инсулин концентрациясы салыстырмалы түрде қалыпты, ал жасушалар глюкозаны қабылдауды және пайдалануды үнемдей алады. Кетон денелерінің жартылай шығарылу кезеңі қысқа, емдік кетозға жету үшін натрий ?OHB тұзын қабылдау немесе инфузия натрийдің жағымсыз жүктемесін тудырады. R/S-1,3-бутандиол улы емес диалкоголь болып табылады, ол бауырда d/l-?OHB алу үшін оңай тотығады (Desrochers және т.б., 1992). Әртүрлі эксперименттік контексттерде бұл доза тышқандарға немесе егеуқұйрықтарға жеті апта бойы күн сайын енгізілді, енгізгеннен кейін 5 сағат ішінде 2 мМ-ге дейінгі айналымдағы OHB концентрациясын берді, ол кемінде қосымша 3 сағат (D') тұрақты болады. Agostino және т.б., 2013). R/S-1,3-бутандиол (Carpenter and Grossman, 1983) берілген кеміргіштерде тағам қабылдаудың ішінара басылуы байқалды. Сонымен қатар, үш химиялық әр түрлі кетон эфирлері (KEs), (i) R-1,3-бутандиолдың моноэфирі және d-?OHB (R-3-гидроксибутил R-?OHB); (іі) глицерин-трис-?OHB; және (iii) R,S-1,3-бутандиол ацетоацетат диэстері де жан-жақты зерттелген (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a Desrochers et al. ., 1995b; Кашивая және т.б., 2010). Біріншісінің тән артықшылығы ішекте немесе бауырда эстеразалық гидролизден кейін KE мольіне 2 моль физиологиялық d-?OHB түзілуі болып табылады. Қауіпсіздік, фармакокинетика және төзімділік R-3-гидроксибутил R-?OHB-ны 714 мг/кг-ға дейінгі дозада қабылдаған, айналымдағы d-?OHB концентрациясын 6 мМ-ге дейін беретін адамдарда кеңінен зерттелген (Кларк және т.б., 2012a; Кокс және басқалар, 2016; Кемпер және басқалар, 2015; Шивва және басқалар, 2016). Кеміргіштерде бұл KE калорияны тұтынуды және плазмадағы жалпы холестеринді төмендетеді, қоңыр май тінін ынталандырады және инсулинге төзімділікті жақсартады (Кашивая және басқалар, 2010; Кемпер және басқалар, 2015; Veech, 2013). Жақында алынған нәтижелер жаттығу кезінде жаттығу кезінде R-3-гидроксибутил R-?OHB ішке қабылдау қаңқа бұлшықетінің гликолизін және плазмадағы лактат концентрациясын төмендететінін, бұлшықетішілік триацилглицерин тотығуының жоғарылауын және бұлшықет гликогенінің мазмұнын, тіпті көмірсулар бір мезгілде қабылдаған кезде де (инсулин секрециясын ынталандырған) сақтайтынын көрсетеді. Кокс және т.б., 2016). Бұл қызықты нәтижелерді одан әрі дамыту қажет, өйткені шыдамдылық жаттығуларының көрсеткіштерінің жақсаруы негізінен 2/8 субъектілеріндегі KE-ге сенімді жауаппен байланысты болды. Дегенмен, бұл нәтижелер басқа субстраттарға қарағанда кетон тотығуына артықшылық беретін классикалық зерттеулерді қолдайды (GARLAND және т.б., 1962; Хассельбайнк және басқалар, 2003; Stanley және т.б., 2003; Валенте-Силва және т.б., 2015), соның ішінде жаттығу кезінде және дайындалған спортшылар кетондарды қолдануға көбірек дайын болуы мүмкін (Джонсон және басқалар, 1969a; Джонсон және Уолтон, 1972; Виндер және басқалар, 1974; Виндер және басқалар, 1975). Соңында, бірдей калорияны тұтынудан (макронутриенттер арасында дифференциалды түрде бөлінген) және оттегінің бірдей тұтыну жылдамдығынан кейін жаттығулардың жақсаруына қолдау көрсететін механизмдер әлі де анықталуды жалғастыруда.
Болашақ перспектива
Көмірсулар шектеулі күйде (кетотоксиктік парадигма) майдың жануынан болатын улы шығарындыларды жинақтауға қабілетті толып кету жолы ретінде стигматизацияланған соң, жақында жүргізілген бақылаулар кетон организмінің метаболизмі көмірсулар көп жағдайда да пайдалы рөл атқаратыны туралы түсінікті қолдайды. � гипотеза. Кетон метаболизмін басқаруға арналған қарапайым тағамдық және фармакологиялық тәсілдер оны тартымды емдік мақсатқа айналдырғанымен, агрессивті түрде қойылған, бірақ мұқият эксперименттер негізгі және аудармалық зерттеу зертханаларында қалады. Қанағаттанбаған қажеттіліктер жүрек жеткіліксіздігі, семіздік, NAFLD/NASH, 2 типті қант диабеті және қатерлі ісіктердегі кетон алмасуының рөлін анықтау салаларында пайда болды. Кетон денелерінің «канондық емес» сигналдық рөлдерінің ауқымы мен әсері, соның ішінде метаболикалық және сигналдық жолдарға кері және алға қарай беретін PTM реттеуі тереңірек зерттеуді қажет етеді. Соңында, бауырдан тыс кетогенез қызықты паракриндік және автокриндік сигнал беру механизмдерін және терапиялық мақсаттарға жету үшін жүйке жүйесі мен ісіктердегі бірлескен метаболизмге әсер ету мүмкіндіктерін ашуы мүмкін.
Алғыс
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Сілтемелер
Қорытындылай келе, кетондық денелерді адам ағзасында глюкоза жеткіліксіз болған кезде энергия көзі ретінде пайдалану үшін бауыр жасайды. Кетогенез қандағы глюкоза деңгейі төмен болған кезде, әсіресе басқа жасушалық көмірсулар қоры таусылғаннан кейін пайда болады. Жоғарыдағы мақаланың мақсаты кетон денелерінің отын алмасуындағы, сигнал берудегі және терапиядағы көп өлшемді рөлдерін талқылау болды. Біздің ақпаратымыздың көлемі хиропротикалық және омыртқаның денсаулығына қатысты мәселелермен шектеледі. Тақырыпты талқылау үшін доктор Хименеске хабарласыңыз немесе бізге телефон арқылы хабарласыңыз915-850-0900 .
Доктор Алекс Хименес мырзаның жетекшілігімен
Сілтеме:�Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Қосымша тақырыпты талқылау: Жедел арқа ауруы
Арқа ауруыWorldwide бұл бүкіл әлем бойынша мүгедектіктің және жұмыссыз қалған күндердің ең көп таралған себептерінің бірі. Арқадағы ауырсыну тек жоғарғы тыныс жолдарының инфекцияларымен санасқан дәрігерлерге жүгінудің екінші жалпы себебі болып табылады. Халықтың шамамен 80 пайызы өмір бойы кем дегенде бір рет арқа ауруы болады. Омыртқа - бұл басқа жұмсақ тіндердің арасында сүйектерден, буындардан, байламдардан және бұлшықеттерден тұратын күрделі құрылым. Жарақаттар және / немесе ауырлататын жағдайлар, мысалықатты дискілер, ақыр соңында арқадағы ауырсыну белгілеріне әкелуі мүмкін. Спорттық жарақаттар немесе көлік апаты жарақаттары көбінесе арқадағы ауырсынудың жиі себебі болып табылады, бірақ кейде ең қарапайым қозғалыстар ауыр нәтижелерге әкелуі мүмкін. Бақытымызға орай, хиропрактикалық күтім сияқты емдеудің балама нұсқалары омыртқаны түзетулер мен қолмен манипуляцияларды қолдану арқылы арқадағы ауырсынуды жеңілдетуге көмектеседі, сайып келгенде, ауырсынуды жеңілдетеді.

EXTRA EXTRA | МАҢЫЗДЫ ТАҚЫРЫП: Ұсынылатын El Paso, TX Chiropractor
***
Мұндағы ақпарат «Кетон денелерінің көп өлшемді рөлдері" білікті денсаулық сақтау маманымен немесе лицензиясы бар дәрігермен жеке қарым-қатынасты ауыстыруға арналмаған және медициналық кеңес емес. Біз сізді зерттеулеріңізге және білікті денсаулық сақтау маманымен серіктестікке негізделген денсаулық сақтау туралы шешім қабылдауға шақырамыз.
Блог туралы ақпарат және ауқымды талқылау
Біздің ақпараттық шеңберіміз хиропрактика, тірек-қимыл аппараты, физикалық дәрі-дәрмектер, сауықтыру, этиологиялық әсер етумен шектеледі. висцеросоматикалық бұзылулар клиникалық көрсетілімдер, соматовисцеральды рефлекстің клиникалық динамикасы, сублюксация кешендері, денсаулыққа қатысты сезімтал мәселелер және/немесе функционалдық медицина мақалалары, тақырыптары және талқылаулары.
Біз қамтамасыз етеміз және ұсынамыз клиникалық ынтымақтастық түрлі сала мамандарымен. Әрбір маман өзінің кәсіби тәжірибесімен және лицензиялау юрисдикциясымен реттеледі. Біз тірек-қимыл аппаратының жарақаттары мен бұзылыстарын емдеу және қолдау үшін денсаулық пен сауықтыру функционалдық протоколдарын қолданамыз.
Біздің бейнелеріміз, жазбаларымыз, тақырыптарымыз, тақырыптарымыз және түсініктемелеріміз клиникалық тәжірибемізге тікелей немесе жанама түрде қатысты және оған қатысты мәселелерді, мәселелерді және тақырыптарды қамтиды*.
Біздің кеңсе дәлелді дәйексөздер беруге тырысты және біздің жазбаларымызды қолдайтын тиісті зерттеулерді немесе зерттеулерді анықтады. Сұраным бойынша біз бақылау кеңестеріне және қоғамға қол жетімді ғылыми зерттеулердің көшірмелерін ұсынамыз.
Біз оның белгілі бір күтім жоспарында немесе емдеу хаттамасында қалай көмектесе алатындығы туралы қосымша түсініктеме талап ететін мәселелерді қарастыратынымызды түсінеміз; сондықтан, жоғарыда аталған тақырыпты одан әрі талқылау үшін, сұраңыз Доктор Алекс Хименес, Колумбия округі, Немесе бізбен хабарласыңыз 915-850-0900.
Біз сізге және сіздің отбасыңызға көмектесу үшін осындамыз.
баталар
Доктор Алекс Хименес Тұрақты, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
электрондық пошта: train@elpasofunctionalmedicine.com
Хиропрактика докторы (DC) ретінде лицензияланған Техас & New Mexico*
Texas DC лицензиясы № TX5807, Нью-Мексико DC лицензиясы № NM-DC2182
Тіркелген медбике (RN*) лицензиясы бар in Флорида
Флорида лицензиясы RN лицензиясы # RN9617241 (Басқару №. 3558029)
Шағын күйі: Көп штаттық лицензия: Тәжірибе жасауға рұқсат етілген 40 штаттары*
Доктор Алекс Хименес DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Менің цифрлық визит карточкам